
【题目】元素的第一电离能:Al_________Si(填“>”或 “<”)
 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】将250mL含BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则原混合溶液中钾离子物质的量浓度为
( )
A.4(b﹣2a)mol/L
B.20(2a﹣b)mol/L
C.20(b﹣2a)mol/L
D.10(b﹣a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 ![]() 与NaOH溶液、碘水三者混和后可发生如下反应:
与NaOH溶液、碘水三者混和后可发生如下反应:
①I2+2NaOH=NaI+NaIO+H2O
② ![]()
③ ![]()
此反应称为碘仿反应,根据上述反应方程式推断下列物质中能发生碘仿反应的有( )
A.CH3CHO
B.CH3CH2CHO
C.CH3CH2COCH2CH3
D.CH3CH2COCH2 CH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乙酸的分子式:C2H4O B. 甲烷的分子式:CH4
C. 乙酸的结构简式:CH3CH2OH D. 乙烷的结构简式:C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、J是日常生活中常见的两种金属,J在化合物中存在两种正价;F是常温下的气体单质,各物质有以下的转化关系(部分产物及条件略去). 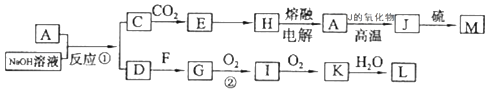
(1)A与NaOH溶液反应的离子方程式为;方程式中氧化剂为 .
(2)写出L的稀溶液与足量的J反应的化学方程式 .
(3)含A元素的某盐X常做净水剂,X做焰色反应时,透过蓝色钴玻璃观察火焰呈紫色.X的水溶液与NaHCO3溶液混合,反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4g NaOH溶解在10mL水中,再稀释成1L,从中取1mL,这1mL溶液的物质的量浓度为( )
A.1molL﹣1
B.0.1molL﹣1
C.0.01molL﹣1
D.10molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生如下反应: aX(g) + bY(g) cZ(g) +d W(g)。反应达平衡后保持温度不变,将气体体积压缩到原来的1/2,当再次达平衡时,W的浓度为原平衡时的1.8倍。下列叙述中不正确的是 ( )
A. 平衡向逆反应方向移动 B. a + b < c + d
C. Z的体积分数增加 D. X的转化率下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO46H2O是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下:
(1)向滤液Ⅰ中加入FeS是为了生成难溶于酸的硫化物沉淀而除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为: .
(2)对滤液Ⅱ的操作,请回答:
①往滤液Ⅱ中加入H2O2的离子方程式: .
②调滤液ⅡpH的目的是除去Fe3+ , 其原理是Fe3++3H2OFe(OH)3+3H+ , 已知25℃时Ksp[Fe(OH)3]=2.8×10﹣39 , 则该温度下上述反应的平衡常数K=
③检验Fe3+是否除尽的操作和现象是 .
(3)滤液Ⅲ溶质的主要成分是NiSO4 , 加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4 , 这两步操作的目的是 .
(4)得到的NiSO4溶液经一系列操作可得到NiSO46H2O晶体,请回答:
①一系列操作主要包括、、等操作.
②为了提高产率,过滤后得到的母液要循环使用,则应该回流到流程中的位置.(填a、b、c、d)
③如果得到产品的纯度不够,则应该进行操作(填操作名称).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com