
【题目】实验室常用Na2SO3和较浓的硫酸反应制备SO2气体,以探究SO2的性质。完成下列填空:
(1)已知SO2是一种强还原性的气体,能使KMnO4溶液褪色,并将锰元素还原为+2价,写出该反应的化学方程式。___________。
(2)比较氧化性强弱:KMnO4______MnSO4(填>、<或=)。
(3)每转移1mol电子,消耗SO2_____L(标准状况)。
科目:高中化学 来源: 题型:
【题目】减少污染、保护环境是全世界最热门的课题。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+![]() O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为______________。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是____(填序号)。
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
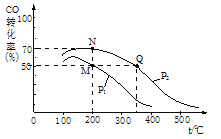
①M、N两点平衡状态下,容器中总物质的物质的量之比为:n(M)总:n(N)总=_____。
②若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为_______。
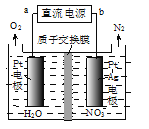
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为_______________。
②电化学降解NO3-的原理如图所示,电源正极为____(填“a”或“b”);若总反应为4NO3-+4H+![]() 5O2↑+2N2↑+2H2O,则阴极反应式为__________________。
5O2↑+2N2↑+2H2O,则阴极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧杯A中盛放0.1mol/L的H2SO4溶液,烧杯B中盛放0.1mol/L的的CuCl2溶液(两种溶液均足量),组成的装置如图所示。下列说法不正确的是

A.A为原电池,B为电解池
B.当A烧杯中产生0.1mol气体时,B烧杯中产生气体的物质的量也为0.1mol
C.经过一段时间,B烧杯中溶液的浓度减小
D.将B中右侧石墨改为铜电极,电极上发生的反应不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g) ![]() C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。
C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。
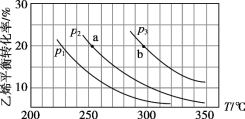
下列分析不正确的是
A. 乙烯气相直接水合反应的H<0
B. 图中压强的大小关系为:p1>p2>p3
C. 图中a点对应的平衡常数K =![]()
D. 达到平衡状态a、b所需要的时间:a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氧化性![]() ,向含溶质
,向含溶质![]() 的
的![]() 溶液中通入
溶液中通入![]() ,充分反应.下列说法不正确的是
,充分反应.下列说法不正确的是
A.离子的还原性强弱:![]()
B.当![]() 时,发生的离子反应:
时,发生的离子反应:![]()
C.当![]() 时,反应后的离子浓度:
时,反应后的离子浓度:![]() ∶
∶![]() ∶
∶![]() ∶2∶2
∶2∶2
D.当![]() 时,发生的离子反应:
时,发生的离子反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶![]() 可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
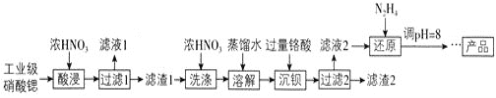
已知:![]() 滤渣1的成分为
滤渣1的成分为![]() 、
、![]() ;
;![]() 铬酸
铬酸![]() 为弱酸。
为弱酸。
![]() 酸浸不能采用高温的原因是____________,滤液1的主要溶质是________。
酸浸不能采用高温的原因是____________,滤液1的主要溶质是________。
![]() 相对于水洗,用浓硝酸洗涤的优点是___________。
相对于水洗,用浓硝酸洗涤的优点是___________。
![]() 滤液2中过量的
滤液2中过量的![]() 被
被![]() 还原为
还原为![]() ,同时放出无污染的气体,写出发生反应的离子方程式:________。
,同时放出无污染的气体,写出发生反应的离子方程式:________。
![]() 已知
已知![]() 类似氢氧化铝,还原后溶液的pH不能大于8的原因是
类似氢氧化铝,还原后溶液的pH不能大于8的原因是![]() 结合离子方程式说明理由
结合离子方程式说明理由![]() __________。
__________。
![]() 为了测定滤渣2中
为了测定滤渣2中![]() 的含量,进行以下实验:
的含量,进行以下实验:
mg滤渣2![]() 溶液
溶液![]()
滴定终点时消耗![]() 溶液
溶液![]() 已知:
已知:![]() 。
。
![]() 滤渣2中
滤渣2中![]() 摩尔质量为
摩尔质量为![]() 的质量分数为___________
的质量分数为___________![]() 用代数式表示
用代数式表示![]() 。
。
![]() 若加入的HI溶液过量太多,测定结果会_________
若加入的HI溶液过量太多,测定结果会_________![]() “偏高”“偏低”或“无影响”
“偏高”“偏低”或“无影响”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
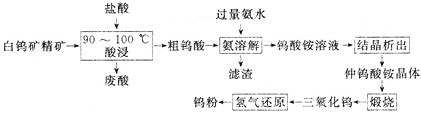
【题目】钨![]() 具有很大的工业价值,主要用于电子工业,合金添加剂等。工业上利用白钨矿精矿为原料
具有很大的工业价值,主要用于电子工业,合金添加剂等。工业上利用白钨矿精矿为原料![]() 主要成分为钨酸钙
主要成分为钨酸钙![]() ,还含有CaO、
,还含有CaO、![]() 等杂质
等杂质![]() 生产钨粉的一种工艺流程如下:
生产钨粉的一种工艺流程如下:
已知:
![]() 钨酸钙微溶于水,能溶解在热盐酸中。
钨酸钙微溶于水,能溶解在热盐酸中。
![]() 降低溶液pH可以从钨酸铵溶液中析出仲钨酸铵晶体,常温时可析出带11个结晶水的仲钨酸铵晶体,但是由于颗粒很细小,难以进一步提纯。在
降低溶液pH可以从钨酸铵溶液中析出仲钨酸铵晶体,常温时可析出带11个结晶水的仲钨酸铵晶体,但是由于颗粒很细小,难以进一步提纯。在![]() 时可析出颗粒较大的带5个结晶水的仲钨酸铵晶体,可进一步提纯精制。
时可析出颗粒较大的带5个结晶水的仲钨酸铵晶体,可进一步提纯精制。
![]() 酸浸时为了提高浸出率,可采取的措施有___________。
酸浸时为了提高浸出率,可采取的措施有___________。![]() 答出两条即可
答出两条即可![]()
![]() 酸浸时,需控制反应温度在
酸浸时,需控制反应温度在![]() 之间的原因是________。
之间的原因是________。
![]() 酸浸时发生的主要反应的化学方程式是____。
酸浸时发生的主要反应的化学方程式是____。
![]() 将废酸与粗钨酸分离的操作是_____
将废酸与粗钨酸分离的操作是_____![]() 填操作名称
填操作名称![]() 。
。
![]() 加入过量氨水后过滤,得到滤渣的主要成分是______
加入过量氨水后过滤,得到滤渣的主要成分是______![]() 填化学式
填化学式![]() 。
。
![]() 工艺流程中“结晶析出”,采用的结晶方法是________。
工艺流程中“结晶析出”,采用的结晶方法是________。
![]() 仲钨酸铵的化学式为
仲钨酸铵的化学式为![]() ,写出仲钨酸铵煅烧转化为
,写出仲钨酸铵煅烧转化为![]() 的化学方程式_______________。
的化学方程式_______________。
![]() 已知白钨矿精矿中的钨酸钙质量分数为
已知白钨矿精矿中的钨酸钙质量分数为![]() ,
,![]() 该精矿经上述流程制得
该精矿经上述流程制得![]() 钨粉。则该生产中钨的产率为_______
钨粉。则该生产中钨的产率为_______![]() 用含“a”“w”“m”的代数式表示
用含“a”“w”“m”的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
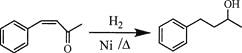
【题目】芳香烃A是基本有机化工原料,由A制备高分子E和医药中间体K的合成路线(部分反应条件略去)如下图所示:

己知:①![]() ;
;
②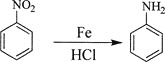
回答下列问题:
(1)A的名称是________,I含有官能团的名称是________。
(2)反应⑦的作用是________,⑩的反应类型是________。
(3)写出反应②的化学方程式:____________________________________________________。
(4)D分子中最多有________个原子共平面。E的结构简式为________。
(5)写出一种同时符合下列条件的F的同分异构体的结构简式:________。
①苯环上只有两种不同化学环境的氢原子;
②既能与银氨溶液反应又能与NaOH溶液反应。
(6)将由D为起始原料制备![]() 的合成路线补充完整。
的合成路线补充完整。
 ________(无机试剂及溶剂任选)。
________(无机试剂及溶剂任选)。
合成路线流程图示例如下:
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com