
| 族 周期 | I A | IIA | IIIA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 二 | | | | ① | ② | | ③ | |
| 三 | | ④ | ⑤ | ⑥ | | | ⑦ | ⑧ |
| 四 | ⑨ | | | | | | ⑩ | |
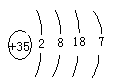
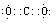
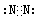

 Si+2CO↑;
Si+2CO↑; ;
;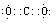 ;②的单质是N2,电子式为
;②的单质是N2,电子式为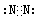 ;
; ;
; Si+2CO↑;
Si+2CO↑; CO2+ 2H2O,根据反应热与化学键键能的关系,△H=(4×414+2×498-2×728-2×2×464)kJ/mol="-660" kJ/mol,所以1mol甲烷完全燃烧放出660kJ的热量。
CO2+ 2H2O,根据反应热与化学键键能的关系,△H=(4×414+2×498-2×728-2×2×464)kJ/mol="-660" kJ/mol,所以1mol甲烷完全燃烧放出660kJ的热量。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②③④ | C.①②④⑤ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

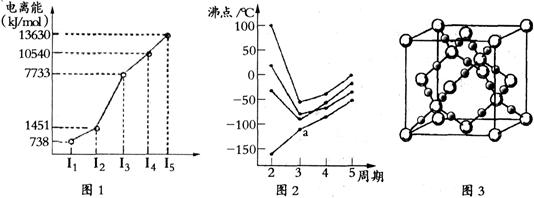
 图2
图2 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.W、M的某种单质可作为水处理中的消毒剂 |
| B.电解YW2的熔融物可制得Y和W的单质 |
| C.相同条件下,w的氢化物水溶液酸性比Z弱 |
| D.X、M两种元素形成的一种化合物与水反应可生成M的某种单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com