
【题目】碳酸二甲酯[(CH3O)2CO]是一种具有发展前景的“绿色”化工产品,电化学合成碳酸二甲酯的工作原理如图所示(加入两极的物质均是常温常压下的物质)。下列说法正确的是
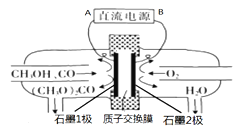
A. B为直流电源正极
B. H+由石墨2极通过质子交换膜向石墨l极移动
C. 石墨l极发生的电极反应为:2CH3OH + CO-2e= (CH3O)2CO + 2H+
D. 电解一段时间后,阴极和阳极消耗的气体的物质的量之比为l∶1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】水钴矿的主要成分为Co2O3,还含SiO2及少量Al2O3、Fe2O3、 CuO、MnO2等。一种利用水钴矿制取CoCl2·6H2O 的工艺流程如下:
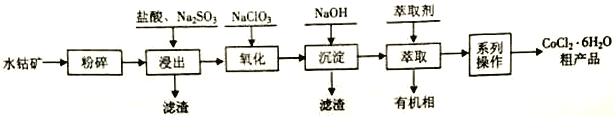
已知: ①CoCl2·6H2O受热易失去结晶水。
②25 ℃时,设定溶液中某金属离子初始浓度为0.1 molL-1,部分沉淀的参考数据如下表(“沉淀完全”指溶液中该离子浓度≤1.0×10-5molL-1):
沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀的pH | 3.4 | 1.5 | 6.3 | 7.0 | 4.7 | 8.1 |
沉淀完全时pH | 4.7 | 2.8 | 8.3 | 9.0 | 6.7 | 10.1 |
回答下列问题
(1)计算25℃时Co(OH)2的Ksp =_______________。
(2)浸出工序中加入一定量的Na2SO3还原Co2O3、MnO2等,Co2O3发生反应的离子方程式为_______________________________。
(3)氧化工序要控制NaClO3用量,若不慎加入过量NaClO3,可能生成的有毒气体是______________;氧化工序主要反应的离子方程式为_______________________________。
(4)已知温度对铜、钴、铁的浸出率的影响如左下图,萃取剂A、B中pH对钴、锰离子萃取率的影响如右下图:

①浸出温度控制在50-60℃的原因是_________________________。
②应选择萃取剂_________________________(填“A”或“B”)。
(5)“系列操作”依次是____________、______________和过滤等;制得的CoCl2·6H2O需减压烘干的原因是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银属于贵重金属,主要应用于化工、电子、感光材料等行业。某研究性学习小组设计一种提取光盘金属层中少量Ag 的方案如下图所示(忽略其他低含量金属对实验的影响) :
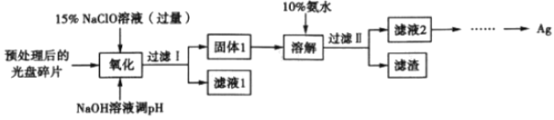
该小组查阅资料得知如下信息:
①NaClO 溶液在受热或酸性条件下易分解,如3NaClO==2NaCl+NaClO3 ;
②AgCl 可溶于氨水:AgCl+2NH3·H2O![]() Ag( NH3)2++Cl-+2H2O。
Ag( NH3)2++Cl-+2H2O。
回答下列问题:
(1)“氧化”步骤的产物为AgCl、NaOH 和O2,则该反应的化学方程式为__________。“氧化”阶段需在80℃条件下进行,温度过高或过低都不利于银的转化,其原因是_______________________________。
(2)该流程中,将银转化为固体1,然后又用氨水溶解转变为滤液2,其目的是_________________。
(3)若省略“过滤I”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO 与NH3·H2O反应外( 该条件下NaClO3与NH3·H2O不反应),还因为____________________。
(4)在实验室用葡萄糖(用GCHO表示)可以将滤液2还原为单质Ag,同时生成NH3,葡萄糖被氧化为葡萄糖酸铵(用GCOONH4 表示)。写出该反应的离子方程式:______________________________________。
(5)下图为该小组设计电解精炼银的示意图,则粗银为______(填“a”或“b”)极。若b 极有少量红棕色气体生成,则生成该气体的电极反应式为______________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常状况下,乙烯(C2H4)是一种无色气体,具有可燃性,其燃烧反应的化学方程式为:C2H4+3O2![]() 2X+2H2O,则下列有关说法正确的是( )
2X+2H2O,则下列有关说法正确的是( )
A. 氧气中氧元素的化合价为-2价
B. 水属于有机化合物
C. X中碳、氧元素的原子个数比为1:2
D. 该反应属于化合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(16分)止咳酮(F)具有止咳、祛痰作用。其生产合成路线如下:
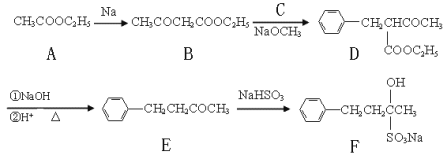
(1)写出B中含有的官能团名称: 。
(2)已知B→D反应属于取代反应,写出C(C属于氯代烃)的结构简式: 。
(3)写出E→F的反应类型: 。
(4)满足下列条件的E的同分异构体有 种。
①苯环上有两个邻位取代基; ②能与FeCl3溶液发生显色反应;
③除苯环外不含其它的环状结构。
(5)写出A→B的反应方程式: 。
(6)A→F六种物质中含有手性碳原子的是: (填物质代号)。
(7)目前我国用粮食发酵生产丙酮(CH3COCH3)占较大比重。利用题给相关信息,以淀粉为原料,合成丙酮。合成过程中无机试剂任选。
提示:合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时CH3COOH的电离平衡常数Ka=1.75×105,NH3·H2O的电离平衡常数Kb=1.75×105。常温时,向10 mL浓度均为0.01mol·L1的NaOH和氨水混合溶液中,逐滴加入0.01mol·L1的 CH3COOH 溶液,混合溶液的pH与加入CH3COOH的体积V之间的变化曲线如图所示,下列有关说法正确的是

A. a 点溶液的pH<12
B. b 点时水的电离程度最大
C. c 点处的微粒间存在:c(CH3COO)=c(NH4+)+c(NH3·H2O)
D. d 点处的微粒间存在:c(CH3COO)>c(H+)>c(Na+)>c(NH4+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NO,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表;
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________________________。增加压强,NO的转化率______(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______(填“提高”“不变”或“降低”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(2在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压px如图所示。
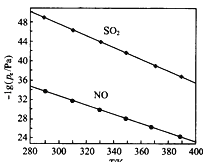
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的有点是_______。
②已知下列反应:
SO2(g)+2OH(aq)==SO32(aq)+H2O(l)ΔH1
ClO(aq)+SO32(aq)===SO42(aq)+Cl(aq)ΔH2
CaSO4(s)==Ca2+(aq)+SO42(aq)ΔH3
则反应SO2(g)+Ca2+(aq)+ ClO(aq)+2OH(aq)===CaSO4(s)+H2O(l)+Cl(aq)的ΔH=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.铝粉投入到NaOH溶液中:2Al+2OH-= 2AlO2-+H2↑
B.铁和稀硝酸反应: Fe+2H+=Fe2++H2↑
C.AlCl3溶液中加入足量的氨水:Al3++ 3OH- = Al(OH)3↓
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2 = 2Fe3++2Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com