
����Ŀ��ijϡ�����ϡ����Ļ����Һ 200mL��ƽ���ֳ����ݡ�������һ��������ͭ�ۣ�������ܽ�9.6 g������һ�����������ۣ�������������������������ӵı仯����ͼ��ʾ����֪����ֻ����ԭ Ϊ NO ���壩�����з�������������ǣ� ��
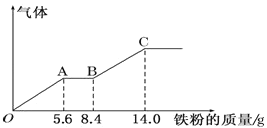
A.�ڶ�����Һ����������ΪFeSO4
B.OA �β������� NO��AB �εķ�ӦΪ Fe+2Fe3+�T3Fe2+��BC �β�������
C.ԭ�������HNO3 �����ʵ���Ϊ 0.8mol
D.H2SO4 Ũ��Ϊ 2.5molL-1
���𰸡�C
��������
������ϡ���ᷢ��������ԭ��Ӧ��������������ϡ���ᷴӦ�����ͼ�������������Ϊ�����������OA�η�����Ӧ��Fe+NO3-+4H+===Fe3++NO��+2H2O��AB�η�ӦΪ��Fe+2Fe3+===3Fe2+��BC�η�ӦΪ��Fe+2H+===Fe2++H2����
A��������������������ȫ������ԭ����Һ��û������������������Ƕ����������Եڶ�����Һ����������ΪFeSO4��Aѡ����ȷ��
B��OA�η�����Ӧ��Fe+NO3-+4H+===Fe3++NO��+2H2O��AB�η�ӦΪ��Fe+2Fe3+===3Fe2+��BC�η�ӦΪ��Fe+2H+===Fe2++H2����Bѡ����ȷ��
C��OA���������ȫ���������ã�Fe �� NO3-�����![]() ������ԭ�����Һ��
������ԭ�����Һ��![]() ����HNO3ҲΪ0.2mol��Cѡ�����
����HNO3ҲΪ0.2mol��Cѡ�����
D��������е����������������У�����������غ㣬����![]() ������H2SO4��Ũ��Ϊ
������H2SO4��Ũ��Ϊ![]() ��Dѡ����ȷ��
��Dѡ����ȷ��
��ѡC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����120�桢1.01��105Paʱ����3LȲ���������Ļ����������ͬ״���µ�14LO2��ϣ����ȼ�պָ���ԭ��״̬ʱ����������������17L����û��������������и����еģ� ��
A.C2H4��C2H6B.C3H4��CH4C.C2H2��CH4D.C4H6��C2H6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��.�����£�����c(H+) ��ͬ�Ĵ���������ң�
(1)��ͬ�����£�ȡ������ļ�������Һ����ϡ��100����ϡ�ͺ����Һ����c(H+) ��С��ϵΪ��
�� _____________�� (������������С������������������ͬ)��
(2)��ȡ25 mL�ļ�������Һ���ֱ����Ũ�ȵ�NaOHϡ��Һ��ȫ��Ӧ�������ĵ�NaOH��Һ�������С��ϵΪV(��) _____________ V(��)��
��.��֪25 ��ʱ�й�����ĵ���ƽ�ⳣ�����£�
���ữѧʽ | HSCN | CH3COOH | HCN | H2CO3 |
����ƽ�ⳣ�� | 1.3��10-1 | 1.8��10-5 | 4.9��10-10 | Ka1=4.3��10-7 Ka2=5.6��10-11 |
(1)25 ��ʱ����20 mL 0.1 mol��L-1 CH3COOH��Һ��20 mL 0.1 mol��L-1 HSCN��Һ�ֱ���20 mL 0.1 mol��L-1 NaHCO3��Һ��ϣ�ʵ���ò������������(V)��ʱ��(t)�ı仯��ͼ��ʾ��
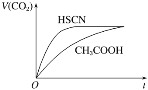
��Ӧ��ʼ��������Һ����CO2��������ʴ������Բ����ԭ���� _____________��
(2)�������¶Ȳ��䣬�ڴ�����Һ��ͨ��һ�������������и������С���� ______________(����ĸ)��
a.c(CH3COO-) b.c(H+) c.Kw d.�������ƽ�ⳣ��
III.(1)HClO4H2SO4HCl��HNO3����ǿ�ᣬ��������ˮ��Һ�в��������ij�¶������������ڱ������еĵ��볣��������˵������ȷ���� _________��
�� | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6��10-5 | Ka1��6.3��10-9 | 1.6��10-9 | 4.2��10-10 |
A.�¶Ȼ�Ӱ�����������ڱ����еĵ��볣��
B.�ڱ�������HClO4��������������ǿ����
C.�ڱ�������H2SO4�ĵ��뷽��ʽΪH2SO4===2H++SO42-
D.���������ڱ������ж�û����ȫ���룬��������ǿ�����
(2)�������Ƕ�Ԫ��ǿ�ᣬ25 ��ʱ������(H3PO3)�ĵ��볣��ΪK1=1��10-2K2=2.6��10-7��
���Դӵ���ƽ���ƶ��ĽǶȽ���K1Ϊʲô��K2��_______________________ ��
��д��������ĵ��뷽��ʽ(2��)_________________��_______________ ��
�������һ�ַ�����ʹ֮��ͨ��ֱ�۵�ʵ�������жϴ��������ǿ��H2S���÷������õ��Լ��� __________����Ӧ�Ļ�ѧ����ʽΪ _____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��25��ʱ��Ksp[Zn(OH)2]=1.0��10-18��Ka(HCOOH)=1.0��10-4�����¶��£�����˵���������
A. Zn(OH)2����ˮ�γɵı�����Һ��c(Zn2+)>1.0��10-6 mol��L-l
B. HCOO-��ˮ�ⳣ��Ϊ1.0��10-10
C. ��Zn(OH)2����Һ�м���HCOOH,��Һ��c(Zn2+)����
D. Zn(OH)2+2HCOOH![]() =Zn2++2HCOO-+2H2O��ƽ�ⳣ��K=100
=Zn2++2HCOO-+2H2O��ƽ�ⳣ��K=100
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����ɫ���壬���������ࡢ�ƾ���ӡˢ��ҽҩ�ȡ���ˮ��Һ���峣����������ɫ�Լ�ƿ�С����������ȶ������ȷֽ����ɹ��塢NO2 �� O2 ��Ϊ����֤ AgNO3 ���ȷֽ�IJ��ijͬѧ���������ʵ�飬ʵ�����õ�װ����ͼ��ͼ�м��ȡ��г������Ⱦ���ȥ����
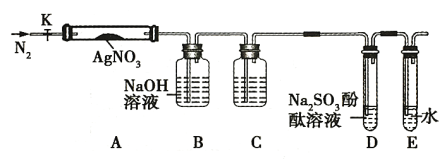
ʵ�鲽�裺
a���������Ӻ���AgNO3����֮ǰ���ر�K����Ӳ�ʲ�����A��
b����ȡ AgNO3 ����1.7g ����A�У���ͨһ��ʱ��N2���ٹر�K���þƾ��Ƽ���Ӳ�ʲ�����A��
c������Ʒ��ȫ�ֽ⣬װ��A��ȴ�����£����������ʣ����������Ϊ1.08 g��
��ش��������⣺
��1��ʹ�þƾ��ƶ�AgNO3������ȵIJ���������_________________��
��2������a�IJ���Ŀ����__________________��
��3������b����ͨһ��ʱ���N2��Ŀ����_____________________��
��4��װ��Cƿ��ʢװ��ҩƷ����Ϊ_____________���������ɣ���װ��D�пɹ۲쵽��ʵ������Ϊ__________________��
��5������ʵ������ͳ����������д����װ����AgNO3�������ȷֽ�Ļ�ѧ����ʽ__________________��
��6����ʵ�鰲ȫ�Ƕȿ��Ǹ�װ�ô���ȱ�ݣ�Ӧ��θĽ���__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4molA��2molB����2L�ܱ������з�����Ӧ2A(g)��B(g)![]() 2C(g) ��H<0
2C(g) ��H<0
��4s��Ӧ�ﵽƽ��״̬����ʱ���C��Ũ��Ϊ0.6mol/L.����˵����ȷ���ǣ�������
A.����������A����������ʹ��Ӧ�ų���������ֵ�ﵽ2��H��
B.4 s�ڣ���(B)��0.075 mol/(L ��s)
C.�ﵽƽ��״̬����ֻ�����¶ȣ���C�����ʵ���Ũ������
D.�ﵽƽ��״̬�����¶Ȳ��䣬��С�������������A��ת���ʽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�������(CH3OCOOCH3�����DMC)��һ��Ӧ��ǰ���㷺���²��ϡ����ܱ������а�n(CH3OH):n(CO2)=2:1Ͷ��ֱ�Ӻϳ�DMC����Ӧ����ʽΪ��2CH3OH(g)+CO2(g)CH3OCOOCH3(g)+H2O(g)��һ�������£�ƽ��ʱCO2��ת������ͼ��ʾ������˵���в���ȷ����( )
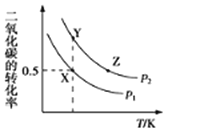
A.�÷�Ӧ������ӦΪ���ȷ�Ӧ
B.ѹǿ![]()
C.X���Ӧ��ƽ�ⳣ��Ϊ![]()
D.X��Y��Z�����Ӧ�ij�ʼ��Ӧ���ʵĹ�ϵΪZ>Y>X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����Ϊ10L���ܱ������У�1molX��1molY���з�Ӧ��2X(g)+Y(g)Z(g)����1min�ﵽƽ�⣬ʣ��![]() ������˵����ȷ����
������˵����ȷ����
A.��ZŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.005mol/(Ls)
B.������ѹǿ��������Y��ת���ʼ�С
C.��c(X)��c(Y)��c(Z)=2��1��1ʱ��������Ӧ����ƽ��״̬
D.�����ֺ��º�ѹ��������ͨ��1molX��1molY���з�Ӧ����ƽ��ʱX��ת���ʽ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�����İ����������ں��ݵ�������������У������������Բ�������ʹ��ﵽ��ѧƽ�⣺H2NCOONH4(s)![]() 2NH3(g)+CO2(g)��ʵ����ò�ͬ�¶��µ�ƽ�����������±�
2NH3(g)+CO2(g)��ʵ����ò�ͬ�¶��µ�ƽ�����������±�
�¶�/�� | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
ƽ����ѹǿ/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
ƽ��������Ũ��/10��3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
�����й�������ȷ����
A. �ڵ���������Ӧ����������
B. 15��ʱ������Ӧ�Ļ�ѧƽ�ⳣ��ԼΪ2.0
C. ���������ƽ������������������ʱ������Ӧ�ﵽ��ѧ��Ӧ��
D. ���������£���ԭƽ����ϵ���ٳ���2molNH3��1molCO2����ƽ���CO2Ũ�Ȳ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com