
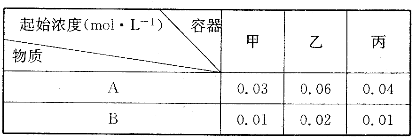
| △c |
| △t |
| 转化的浓度 |
| 起始的浓度 |
| c2(SO3) |
| c2(SO2)?c(O2) |
| △c |
| △t |
| 1.2ml/L |
| 4min |
| 转化的浓度 |
| 起始的浓度 |
| 0.6 |
| 1.5 |
| c2(SO3) |
| c2(SO2)?c(O2) |
| 1.22 |
| 0.82×0.9 |


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
| A、钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、氯气溶于水:Cl2+H2O?2H++Cl-+ClO- |
| C、硫酸溶液中加入铁粉:2Fe+6H+=2Fe3++3H2O |
| D、碳酸氢钠溶液中加入氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 0.1032mol/L HCI体积体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |
| OH- |
| H+ |
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
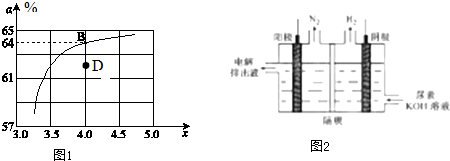
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、固体硝酸铜受热分解 |
| B、Na2O2与足量的稀硫酸反应 |
| C、木炭和浓硫酸共热 |
| D、足量的铜跟一定量的浓硝酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制FeC13溶液时,要滴加少量的盐酸 |
| B、加热蒸干并灼烧Na2SO3溶液,得到Na2SO4固体 |
| C、明矾净水 |
| D、氨态氮肥(含NH4+)不能与草木灰混合使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在世界上我国首先合成了具有生命活力的蛋白质--结晶牛胰岛素 |
| B、蛋白质是组成细胞的基础物质,它是小分子物质 |
| C、蛋白质水解的最终产物是氨基酸 |
| D、高温灭菌的原理是加热后使蛋白质变性,从而使细菌死亡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、鱼胆弄破后会使鱼肉粘上难溶于水的胆汁酸(一种酸)而变苦,要减少这种苦味可加入Na2CO3进行洗涤 |
| B、在制作腊肉可加入少量亚硝酸钠作发色剂和防腐剂 |
| C、把鱿鱼等海鲜浸泡在质量分数为40%的甲醛溶液中防腐保鲜 |
| D、炸油条时,常加入一些明矾和小苏打作疏松剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com