
【题目】nL三种气态烃混合物与足量氧气混合点燃后,恢复到原来状态(常温常压),体积共缩小2nL,这三种烃不可能的组合是 ( )
A. CH4、C2H4、C3H4以任意比混合
B. C2H6、C4H6、C2H2以2:1:2的物质的量之比混合
C. C3H8、C4H8、C2H2以11:14:26的质量之比混合
D. CH4、C3H6、C2H2以a:b:b体积比混合
科目:高中化学 来源: 题型:
【题目】温度为500℃时,反应4NH3+5O2![]() 4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v(x)为 ( )
4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v(x)为 ( )
A.v(O2)=0.01mol/(Ls)B.v(NO)=0.08mol/(Ls)
C.v(H2O)=0.0013mol/(Ls)D.v(NH3)=0.002mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A由碳、氢、氧三种元素组成。现取2.3 g A与2.8 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7 g,碱石灰增重2.2 g。回答下列问题:
(1)2.3 g A中所含氢原子、碳原子的物质的量各是多少_____?
(2)通过计算确定该有机物的分子式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)是一种工业化工原料,可用于制取有机磷农药、长效磺胺药物等,还可用作染料中间体、有机合成的氯化剂和催化剂、阻燃剂等。利用O2和PCl3为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
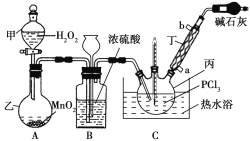
已知PCl3和三氯氧磷的性质如表:
熔点/℃ | 沸点/℃ | 其他物理或化学性质 | |
PCl3 | -112.0 | 76.0 | PCl3和POCl3互溶,均为无色液体,遇水均剧烈水解,发生复分解反应生成磷的含氧酸和HCl |
POCl3 | 1.25 | 106.0 |
(1)装置A中的分液漏斗能否用长颈漏斗代替?做出判断并分析原因:_______
(2)装置B的作用是______________(填标号)。
a.气体除杂 b.加注浓硫酸 c.观察气体流出速度 d.调节气压
(3)仪器丙的名称是___________,实验过程中仪器丁的进水口为__________(填“a”或“b”)口。
(4)写出装置C中发生反应的化学方程式_______,该装置中用温度计控制温度为60~65 ℃,原因是________。
(5)称取16.73 g POCl3样品,配制成100 mL溶液;取10.00 mL溶液于锥形瓶中,加入3.2 mol·L-1的AgNO3溶液10.00 mL,并往锥形瓶中滴入5滴Fe2(SO4)3溶液;用0.20 mol·L-1的KSCN溶液滴定,达到滴定终点时消耗KSCN溶液10.00 mL(已知:Ag++SCN-=AgSCN↓)。则加入Fe2(SO4)3溶液的作用是________,样品中POCl3的纯度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1 mol·L-1、体积分别为Va和Vb的HX溶液与NH3·H2O溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。下列说法不正确的是

A. Ka(HX)的值与Kb(NH3·H2O)的值相等
B. b点,c(NH4+)+c(HX)=0.05 mol·L-1
C. a→c点过程中, 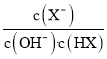 值不变
值不变
D. a、b、c三点,c点时水电离出的c(H+)最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式书写正确的是
A.硝酸铝溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4+↑+2H2O
B.用铝粉和NaOH溶液反应制取大量H2:Al+2OH-=AlO2-+H2↑
C.实验室制取Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.氯气溶于水,与水的反应:Cl2+H2O=2H++Cl-+ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质得不同。下列事实不能说明上述观点的是( )
A. 甲苯能使酸性KMn04溶液褪色,甲基环己烷不能使酸性KMn04溶液褪色
B. 乙烯能与溴水发生加成反应,而乙烷不能与溴水发生加成反应
C. 苯与浓硝酸反应生成硝基苯,而甲苯与浓硝酸反应生成三硝基甲苯
D. 苯酚(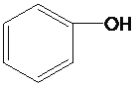 )可以与NaOH反应,而乙醇(CH3CH2OH)不能与NaOH反应
)可以与NaOH反应,而乙醇(CH3CH2OH)不能与NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”已成为全世界科学家研究的重要课题。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)已知:①CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
②C(s)+2H2(g) ![]() CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③2CO(g) ![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:____
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2 L密闭容器中,充入1 mol CO2和3.25 mol H2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:
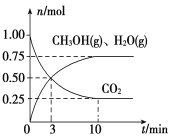
①从反应开始到平衡,氢气的平均反应速率v(H2)=________。
②下列措施一定不能使CO2的平衡转化率增大的是________。
A 在原容器中再充入1 mol CO2
B 在原容器中再充入1 mol H2
C 在原容器中充入1 mol氦气
D 使用更有效的催化剂
E 缩小容器的容积
F 将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
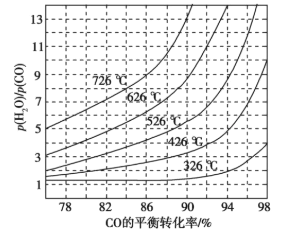
①上述反应的正反应方向是________反应(填“吸热”或“放热”);
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=_____(填表达式,不必代数计算);如果提高p(H2O)/p(CO),则Kp_______(填“变大”“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、p(H2O)/p(CO)=3~5,采用此条件的原因可能是_______
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述错误的是________。

A.该装置能量转化形式仅存在将太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+===CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1mol·L-1的是
A.将80gSO3溶于水并配成1L的溶液
B.10gNaOH固体溶解在水中配成250mL溶液
C.将0.5mol·L-1的NaNO3溶液100mL加热蒸发掉50g水的溶液
D.标准状况下,将22.4L氯化氢气体溶于水配成1L溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com