
| A. | X的原子序数一定为a+2 | |
| B. | Y离子的结构示意图可表示为 | |
| C. | 若b-a=6.则X和Y形成的化合物一定为离子化合物 | |
| D. | X有可能是非金属元素 |
分析 处于短周期中且相邻周期的X、Y两元素,它们形成的简单离子的电子层相差2层,已知X处于第a主族,Y处于第b主族,b>a,且Y单质中只有共价键,则X为H时,Y为第二周期的N、O、F等;若X为Li或Be,则Y为第三周期的Cl,以此来解答.
解答 解:处于短周期中且相邻周期的X、Y两元素,它们形成的简单离子的电子层相差2层,已知X处于第a主族,Y处于第b主族,b>a,且Y单质中只有共价键,则X为H时,Y为第二周期的N、O、F等;若X为Li或Be,则Y为第三周期的Cl,
A.X为H时,不符合X的原子序数为a+2,故A错误;
B.Y单质中只有共价键,Y不可能为Na,故B错误;
C.若b-a=6,X为H,Y为F,则X和Y形成的化合物HF为共价化合物,故C错误;
D.由上述分析可知,X可能是非金属元素H,故D正确;
故选D.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、原子结构为解答的关键,侧重分析与应用能力的考查,注意相差2个电子层,题目难度不大.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:解答题
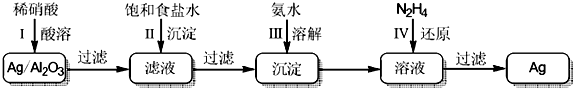
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
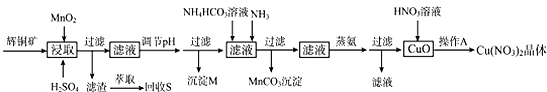
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 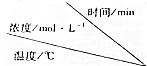 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| Ⅰ | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| Ⅱ | 800 | c1 | c2 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | 乙醇反应时断键部位 | B | 基团的相互影响 |
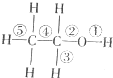 (1)和浓硫酸共热到170℃时②⑤断键 (2)和浓硫酸共热到140℃时只断键② | (1)与钠反应时乙醇比水慢,说明受乙基影响,醇羟基中H原子活泼性减弱 (2)苯酚浊液中加Na0H溶液变澄清,说明受苯环影响,酚羟基中H原子活泼性增强 | ||
| C | 分离提纯 | D | 醇、酚用途 |
| (1)工业乙醇通过蒸馏得无水乙醇 (2)苯中混有苯酚,加溴水沉淀后过滤,除去三溴苯酚沉淀 | (1)甘油加水作护肤剂 (2)酚类化合物有毒,不能用于杀菌消毒 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
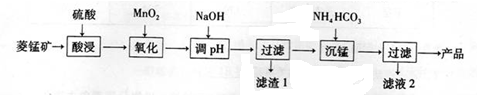
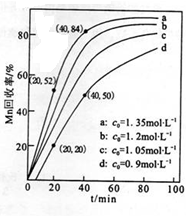
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 燃料电池中燃料都在负极发生氧化反应 | |
| C. | Fe3O4俗称铁红,常作红色油漆和涂料 | |
| D. | 工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com