
| A. | H2S和SO2 | B. | O2 | C. | H2S | D. | SO3 |
分析 H2S和O2的混合气体点燃后充分反应,如氧气足量发生2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,剩余气体可能为SO2或二者都有;如氧气不足,发生2H2S+O2$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O,剩余气体H2S,以此解答该题.
解答 解:①如氧气足量,则发生2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,
如剩余气体为O2和SO2或SO2,则H2S和O2共反应200mL-20mL=180mL,则反应的H2S体积为180mL×$\frac{2}{5}$=72mL,
则生成SO2的体积为72mL>20mL,不符合题意;
②若生成产物为SO2和S,则SO2为10ml,
则先后发生 2H2S+O2 $\frac{\underline{\;点燃\;}}{\;}$ 2S+2H2
$\frac{2}{3}×180$ $\frac{1}{3}×180$
S+O2$\frac{\underline{\;点燃\;}}{\;}$ SO2,
20ml 20ml
即H2S为120mL,O2为80mL,二者体积之和为200ml,符合题意;
③如剩余气体为H2S,则发生2H2S+O2$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O
H2S和O2共反应200mL-20mL=180mL,则H2S为180mL×$\frac{2}{3}$+20mL=140mL,O2为180mL×$\frac{1}{3}$=60mL,二者体积之和为200ml,符合题意,
选项中只有C符合.
故选C.
点评 本题考查了混合物的计算,该题是基础性试题的考查,侧重对学生基础性知识的巩固和训练,有利于培养学生的规范答题能力,提高学生灵活运用基础知识解决实际问题的能力,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
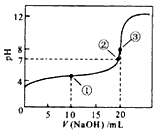 (1)常温下,用0.1000mol/LNaOH溶液滴定20.00ml 0.1000mol/L CH3COOH溶液所得滴定曲线如图.
(1)常温下,用0.1000mol/LNaOH溶液滴定20.00ml 0.1000mol/L CH3COOH溶液所得滴定曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a% | B. | $\frac{3}{4}$a% | C. | $\frac{6(1-a%)}{7}$ | D. | $\frac{12(1-a%)}{13}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5mol | B. | 4.5mol | C. | 1.5mol | D. | 0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 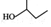 的名称为2-甲基-1-丙醇 的名称为2-甲基-1-丙醇 | B. | 氯乙烯和聚乙烯均能发生加成反应 | ||
| C. | C3H2Cl6 有4种同分异构体 | D. | C2H4和C4H8一定是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
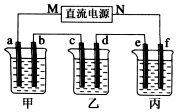 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 离子半径(pm) | 开始沉淀 时的pH | 完全沉淀 时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com