
分析 (1)依据方程式4Na+TiCl4═4NaCl+Ti,结合反应中钠元素化合价变化判断钠的性质;
(2)铝热反应的原理是活泼金属在高温下置换出其它金属;
(3)“侯氏制碱法”的基本原理是:在浓氨水中通入足量的二氧化碳生成一种盐,然后在此盐溶液中加入细的食盐粉末.原始原料有浓氨水、二氧化碳、氯化钠.
解答 解:(1)4Na+TiCl4═4NaCl+Ti,反应中钠化合价升高,所以钠做还原剂表现为还原性,故答案为:还原;
(2)铝热反应在工业生产中的重要用途之一是焊接钢轨,故答案为:焊接钢轨;
(3)食盐为侯氏制碱法中重要的原料之一,故答案为:制备纯碱.
点评 本题考查了物质的性质与用途,涉及钠、氯化钠、铝的用途,熟悉物质的性质是解题关键,注意铝热反应、侯氏制碱法原理,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 双氧水、高锰酸钾溶液可以完全灭活埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理相同 | |
| B. | 用乙醚从黄花蒿中提取青蒿素是利用了氧化还原反应原理 | |
| C. | 在某爆炸事故救援现场,消防员发现存放金属钠、电石、甲苯二异氰酸酯等化学品的仓库起火,应立即用泡沫灭火器将火扑灭 | |
| D. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
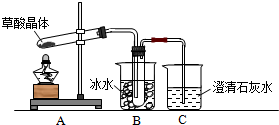
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高分子分离膜 | B. | 隐形眼镜 | C. | 人造丝 | D. | 人造骨酪 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
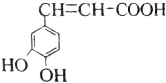
| A. | 与该芳香族化合物分子式相同、官能团种类及数目均相同且苯环上的一氯代物只有两种的有机物的结构有4种(不考虑空间异构) | |
| B. | 咖啡酸只能加聚成高分子化合物 | |
| C. | 咖啡酸最多可与5mol氢气发生加成反应 | |
| D. | 1mol该物质与足量的Na2CO3溶液反应,能消耗3molCO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
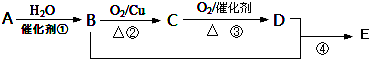
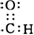 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y间可形成离子化合物 | |
| B. | 单质熔点:Y>W>X | |
| C. | 最高价氧化物对应水化物的酸性:Z>W | |
| D. | Y、W形成的单核离子均能破坏水的电离平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com