
| A.配位体是Cl-和H2O,配位数是9 |
| B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+ |
| C.内界和外界中的Cl-的数目比是1:2 |
| D.加入足量AgNO3溶液,所有Cl-均被完全沉淀 |
科目:高中化学 来源:不详 题型:填空题

 ,则分子中 σ 键与 π 键之比为
,则分子中 σ 键与 π 键之比为 | A.离子键 | B.金属键 | C.配位键 | D.非极性键 E.极性键 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 化学式 | 键长/nm | 键角 | 沸点/℃ |
| H2S | 1.34 | 92.3o | 一60.75 |
| H2Se | 1.47 | 91.0o | 一41.50 |
| 编号 | I5/kJ·mol-1 | I6/kJ·mol-1 | I7/kJ·mol-1 | I8/kJ·mol-1 |
| A | 6990 | 9220 | 11500 | 18770 |
| B | 6702 | 8745 | 15455 | 17820 |
| C | 5257 | 6641 | 12125 | 13860 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。 的立体构型是 。
的立体构型是 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 键的数目为 。
键的数目为 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键。 |
| B.HF、HCl、HBr、HI的熔点沸点依次升高。 |
| C.乙醇分子与水分子之间只存在范德华力。 |
| D.氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 、NA的计算式表示)
、NA的计算式表示)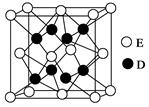
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com