
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1 mol•L-1NaClO溶液中:c(OH-)=c(H+)+c(HClO) | |
| C. | 某温度下,CH3COOH溶液中滴入NaOH溶液,使溶液pH=7时:c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 已知酸性:HCOOH>CH3COOH,相同浓度的HCOOK与CH3COONa溶液中:c(K+)-c(HCOO-)>c(Na+)-c(CH3COO-) |
分析 A.碳酸氢钠溶液中,HCO3-的水解程度大于其电离程度,则c(CO32-)<c(H2CO3);
B.根据次氯酸钠溶液中的质子守恒进行分析;
C.温度影响水的离子积,不是常温下,pH=7的溶液不是中性,则c(H+)≠c(OH-);
D.相同浓度的HCOOK与CH3COONa溶液中,钾离子和钠离子浓度相等,根据酸性越强,对应酸根离子的水解程度越小进行判断c(HCOO-)、c(CH3COO-)的浓度大小即可.
解答 解:A.在0.1 mol•L-1NaHCO3溶液中,由于HCO3-的水解程度大于其电离程度,则c(CO32-)<c(H2CO3),正确的浓度大小为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故A错误;
B.在0.1 mol•L-1NaClO溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HClO),故B正确;
C.某温度下,CH3COOH溶液中滴入NaOH溶液,使溶液pH=7时,此时溶液不一定为中性,则不一定满足c(H+)=c(OH-),无法判断c(CH3COO-)、c(Na+)的大小,故C错误;
D.由于酸性HCOOH>CH3COOH,相同浓度的HCOOK与CH3COONa溶液中,CH3COO-的水解程度大于HCOO-,则溶液中离子浓度:c(HCOO-)>c(CH3COO-),而钾离子和钠离子浓度相等,则c(K+)-c(HCOO-)<c(Na+)-c(CH3COO-),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理、电荷守恒、质子守恒等知识的含义为解答关键,试题充分考查学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
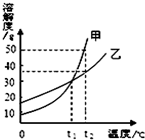
| A. | 甲的溶解度大于乙的溶解度 | |
| B. | 升高温度可使甲的不饱和溶液变为饱和溶液 | |
| C. | t1℃时,甲、乙两种饱和溶液的溶质质量分数相等 | |
| D. | t2℃时,50g乙加入100g水中得到乙的不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中K+、Fe2+、SCN-、Br-可以大量存在 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-═Fe2++I2 | |
| C. | 和Ba(OH)2溶液反应离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 1L0.1 mol•L-1该溶液和足量的Zn充分反应,生成11.2gFe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 据报道,苹果公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.
据报道,苹果公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种重要的有机化工原料.
)是一种重要的有机化工原料.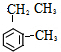 .
. (假设按1:1:1的单体比例合成).
(假设按1:1:1的单体比例合成). ,制取写出相关的化学方程式:
,制取写出相关的化学方程式: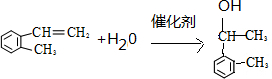 、
、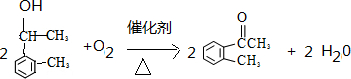 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
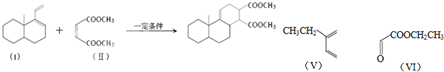
 .
. .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下67.2 L乙烯所含的碳碳双键数与78 g苯所含的碳碳双键数 | |
| B. | 18g重水(D2O)与20g Ne含有相等的电子数 | |
| C. | 1mol CaC2与78 g Na2O2两种固体所含的阴、阳离子总数相等 | |
| D. | 在平衡体系PCl5(g)?PCl3(g)+Cl2(g)中加入一定量的37Cl2,一段时间后,37Cl存在于五氯化磷、三氯化磷和氯气这三种物质中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com