
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列叙述正确的是( )
A.T、Q的氢化物常态下均为无色气体
B.L、M的单质与稀盐酸反应速率:M > L
C.R的氧化物对应的水化物可能具有两性
D.L、Q形成的简单离子核外电子数相等
科目:高中化学 来源: 题型:
化学反应可视为旧键短裂和新键形成的过程。共价键的键能是两种原子间形成1mol共价键(或其可逆过程)时释放(或吸收)的能量。已知H-H 键的键能为436kJ·mol-1 ,Cl-Cl键的键能为243 kJ·mol-1 ,H-Cl键的键能为431 kJ·mol-1 ,则H2 (g ) + Cl2 (g ) == 2HCl(g ) 的反应热(△H )等于( )
A.-183 kJ·mol-1 B.183 kJ·mol-1 C.-862 kJ·mol-1 D.862 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)= H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.1/2H2SO4(aq)+1/2Ba(OH)2(aq)=1/2BaSO4(s)+H2O(l)ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关微粒之间关系和特征描述正确的是( )。
| 选项 | 微粒 | 相互关系 | 特征描述 |
| A | C60、C70、C540 | 同位素 | 微粒中只含非极性共价键 |
| B | 新戊烷、2,2-二甲基丙烷 | 同分异构体 | 常温常压下呈气态 |
| C |
| 同素异形体 | 铂作氨催化氧化时的催化剂 |
| D | 甲酸、硬脂酸 | 同系物 | 能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.需要加热的化学反应都是吸热反应
B.原电池是将电能转化为化学能的一种装置
C.物质的燃烧都是放热反应
D.化学键的形成需吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示。下列说法正确的是( )
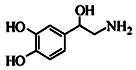
A.每个去甲肾上腺素分子中含有3个酚羟基
B.1mol去甲肾上腺素最多能与2molBr2
C.甲肾上腺素分子不能与饱和的碳酸氢钠溶液发生反应
D.去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
我国制碱工业的先驱——侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+C02+NaCl+H20→NH4CI+NaHCO3(晶体),依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。
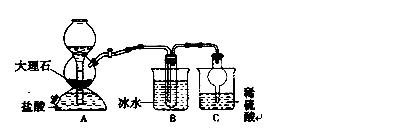
34.A装置中所发生反应的离子方程式为 C装置的作用为
35. 下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g水);
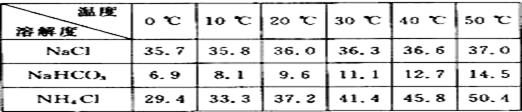
参照表中数据,请分析B装置中使用冰水的目的是 36.该校学生在检查完此套装置的气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在 装置之间(填写字母)连接一个盛有 的洗气装置,其作用 。 37.若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85 g,实验后得到干燥的NaHCO3晶体的质量为5.04 g,则NaHCO3的产率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于如图所示装置的叙述,正确的是( )

A. 铜是阳极,铜片上有气泡产生
B. 盐桥中的阳离子会移向CuSO4溶液
C. 正极附近的SO42﹣离子浓度逐渐增大
D. 锌离子在锌片表面被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
将1 mol Na和1 mol Al的混合物投入足量水中,产生气体在标准状况下的体积为( )
A.11.2 L B.22.4 L
C.33.6 L D.44.8 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com