
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.分析 (1)根据配制溶液的实验操作过程选择所需的仪器和不需要使用的仪器;
(2)根据c=$\frac{1000ρω}{M}$计算浓H2SO4的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积,根据所需浓硫酸的体积选择量筒规格;
(3)定容时,不小心液面超过了刻度,必须重新配制.
解答 解:(1)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.由提供的仪器可知还需要仪器有:100mL容量瓶、玻璃棒,不需要的仪器有:②烧瓶;④药匙;⑥托盘天平;
故答案为:②④⑥;100mL容量瓶、玻璃棒;
(2)浓H2SO4的物质的量浓度c=$\frac{1000×1.84g/L×98%}{98g/mol}$=18.4mol/L;
根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,则有:xmL×18.4mol/L=100mL×1mol/L,解得:x≈5.4.
所需浓硫酸的体积为5.4mL;
量筒规格越接近所需浓硫酸体积误差越小,所以选择10mL量筒.
故答案为:18.4;5.4;①;
(3)用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,无论采取A、B、C的何种方式都不能配制成需要的溶液,只能重新配制,
故答案为:D.
点评 本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,贴近高考;该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意掌握误差分析的方法与技巧.


科目:高中化学 来源: 题型:选择题
| A. | 玻璃属于非金属材料,其主要成分是碳酸盐 | |
| B. | 玻璃钢是一种复合材料,由塑料和铁丝复合而成 | |
| C. | 有机物合成材料属于高分子材料,在汽车轮胎、棉花、塑料制品中都存在 | |
| D. | 氮化硅陶瓷是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COO-+H2O?CH3COOH+OH- | B. | HCO3-+H2O?CO32-+H3O+ | ||
| C. | CH3COOH+OH-?CH3COO-+H2O | D. | NaCl+H2O?NaOH+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 面粉生产车间应严禁烟火 | |
| B. | NH3泄露时向空中喷洒水雾 | |
| C. | 含Cl2的尾气用碱溶液处理后再排放 | |
| D. | 金属钠失火时应立即用大量冷水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;与M同一周期的主族元素中原子半径最小的是(填元素符号)Cl.
;与M同一周期的主族元素中原子半径最小的是(填元素符号)Cl. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
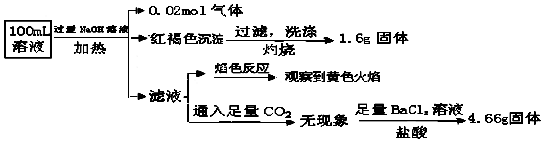
| A. | 原溶液中c(Fe3+)=0.2mol•L-1 | |
| B. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2mol•L-1 | |
| C. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ一定不存在 | |
| D. | 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
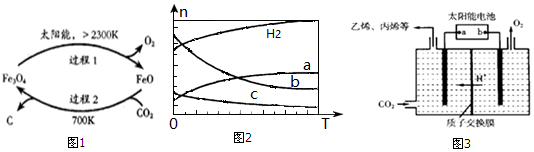
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
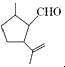 ,下列检验X中既含碳碳双键又含醛基的试剂和顺序正确的是( )
,下列检验X中既含碳碳双键又含醛基的试剂和顺序正确的是( )| A. | 先加酸性高锰酸钾溶液,后加银氨溶液,加热 | |
| B. | 先加溴水,后加酸性高锰酸钾溶液 | |
| C. | 先加银氨溶液,加热,再加入溴水 | |
| D. | 先加入新制氢氧化铜悬浊液,加热,取清液酸化后再加溴水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com