
【题目】下列有关物质应用的说法正确的是
A. 生石灰用作食品抗氧化剂
B. 氢氟酸能与SiO2反应,故可用氢氟酸在玻璃上蚀刻标记
C. 铝罐可久盛咸的食物
D. 苏打是面包发酵粉的主要成分之一
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+= CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu = Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,c(Ag+)由大到小的顺序为:_________。
(2) 含有Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O![]() 。为了使废水的排放达标,进行如下处理:Cr2O
。为了使废水的排放达标,进行如下处理:Cr2O![]()
![]() Cr3+、Fe3+
Cr3+、Fe3+![]() Cr(OH3)、Fe(OH)3
Cr(OH3)、Fe(OH)3
(a) 该废水中加入绿矾和H+,发生反应的离子方程式为__________________。
(b) 若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol·L-1,则残留的Cr3+的浓度为_____
(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
(3)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。请回答下列问题:
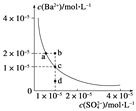
(a) 下列说法正确的是________(填序号)。
A.向BaSO4饱和溶液中加入固体Na2SO4可以由a点变到b点
B.通过蒸发可以由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
(b) 将100 mL 1 mol·L-1 H2SO4溶液加入100 mL含Ba2+ 0.137 g的溶液中充分反应后,过滤,滤液中残留的Ba2+的物质的量浓度约为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
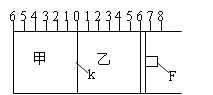
(1)可根据 _______________现象来判断甲乙都已达到平衡状态。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是___________________。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,反应化学平衡常数为______________(带单位)
Ⅱ.若一开始就将K、F如图固定,其他条件均不变,则达到平衡时:
(1)测得甲中A的转化率为b,则乙中C的转化率为 _________________ ;
(2)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 ____________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A.1mol SO42- 的质量是96 gB.1mol H2O的质量是18 g/mol
C.CO2的摩尔质量是44 gD.HCl的相对分子质量是36.5 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】有机物E是医药合成中间体.其合成路线如图:
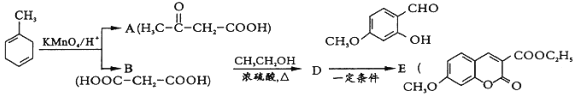
(1)![]() 的官能团名称为______.
的官能团名称为______.
(2)已知![]() 的系统命名为 2-丙酮酸,则A的名称是________________.
的系统命名为 2-丙酮酸,则A的名称是________________.
(3)D为二元酯,则B→D的化学方程式为________________________________________.
D→E的反应历程如图:

(4)写出这几步的反应类型:I_____________,Ⅱ____________III____________
(5)![]() 中能与稀 NaOH溶液反应的官能团是______.检验该官能团的方法是__________________________________________.
中能与稀 NaOH溶液反应的官能团是______.检验该官能团的方法是__________________________________________.
(6)写出满足下列条件的D的所有同分异构体的结构简式______________________________.
a.核磁共振氢谱有3组峰
b.常温下能与NaHCO3按1:2反应并释放出气体
(7)由化合物A经过两步便可以合成环境友好型高聚物聚3-羟基丁酸酯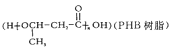
请写出反应合成线路,结合已知信息选用必要的无机试剂,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列有机物的判断错误的是( )
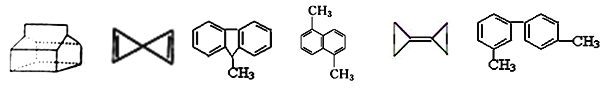
① ② ③ ④ ⑤ ⑥
A. 除①外,其它有机物均可使酸性高锰酸钾溶液褪色
B. ③④⑥都属于芳香烃。④⑥苯环上的一溴代物的同分异构体数目均有6种
C. ②⑤的一氯代物均只有一种,①的一氯代物有四种,④苯环上的二氯代物有9种,
D. ④⑤⑥的所有碳原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下微型实验装置用以验证SO2的性质,通过分析实验,下列结论表达不正确的是( )
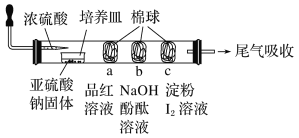
A. a棉球褪色,验证SO2具有漂白性
B. b棉球褪色,验证SO2具有酸性氧化物的性质
C. c棉球蓝色褪去,验证SO2具有还原性
D. 只能用烧碱溶液吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS)是一种高效的无机高分子絮凝剂。某工厂利用经浮选的硫铁矿烧渣(有效成分为Fe2O3 和Fe3O4)制备PFS,其工艺流程如下图所示。

(1)还原焙烧过程中,CO还原Fe3O4生成FeO的热化学方程式为________________________。
已知: Fe3O4(s)+C(s)= 3FeO(s)+CO(g) ΔH1=+191.9kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
C(s)+CO2(g)=2CO(g) ΔH3=+172.5kJ·mol-1
(2)CO是还原焙烧过程的主要还原剂。下图中,曲线表示4个化学反应a、b、c、d达到平衡时气相组成和温度的关系,I、Ⅱ、Ⅲ、Ⅳ分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域。a属于_________(填“吸热反应”或“放热反应”);570℃时,d反应的平衡常数K= ____________。

(3)工业上,还原焙烧的温度一般控制在800℃左右,温度不宜过高的理由是___________________。
(4)若“酸浸”时间过长,浸出液中Fe2+含量反而降低,主要原因是___________________________。
(5)FeSO4溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4,该反应的离子方程式为_____________________________。“催化氧化”过程用NaNO2作催化剂(NO起实质上的催化作用)时,温度与Fe2+转化率的关系如右图所示(反应时间相同),Fe2+转化率随温度的升高先上升后下降的原因是___________________________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com