
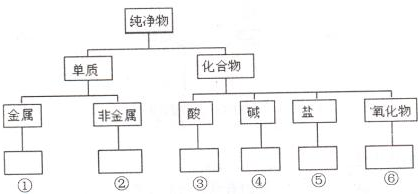
 在化学研究中,化学家常常先对物质进行分类,以便对同类物质的组成和性能进行深入的研究,请你将下列物质N2、HClO、CuO、KOH、NaHCO3、Fe3O4、Mg、S的正确分类填入相应的方框内:
在化学研究中,化学家常常先对物质进行分类,以便对同类物质的组成和性能进行深入的研究,请你将下列物质N2、HClO、CuO、KOH、NaHCO3、Fe3O4、Mg、S的正确分类填入相应的方框内:

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 3 |
| O | - 3 |
| O | - 4 |
| O | 2- 3 |
2- 3 |
- 3 |
| O | 2- 4 |
2- 4 |
- 4 |
2- 3 |
2- 3 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 平衡 常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |


+ 4 |
2- 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室常用的浓盐酸物质的量浓度约为12.0mol?L-1.
实验室常用的浓盐酸物质的量浓度约为12.0mol?L-1.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯、溴水、铁粉混合制成溴苯 |
| B、加浓溴水,然后过滤可除去苯中少量苯酚 |
| C、用高锰酸钾酸性溶液来区别甲烷和乙烯 |
| D、可用水来鉴别苯跟四氯化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com