
【题目】以粗氧化镍(主要含NO、CoO等)为原料制备纯镍,先用CO还原粗氧化镍制备羰化镍,羰化后的产物为Co2(CO)8、Ni(CO)4已知反应为:
①CO2(g)+C(s)2CO(g)△H
②Ni(s)+4CO(g)Ni(CO)4(g)△H<0.
Ni(CO)4的沸点43.2℃,熔点﹣19.3℃,分解温度135℃;Co2(CO)8沸点72℃,熔点31℃。下列有关叙述中不正确的是( )

A.①反应在900℃进行,温度升高,K增大,说明正反应△H>0
B.蒸馏提取Ni(CO)4应选择的适宜温度范围是43.2℃﹣72℃
C.蒸馏后采用230℃分解Ni(CO)4(g)制取金属镍,所获金属镍中常常含有碳
D.提纯粗镍若简化为图装置,则温度T1>T2
科目:高中化学 来源: 题型:
【题目】五倍子是一种常见的中草药,其有效成分为X,在一定条件下X可分别转化为Y、Z。
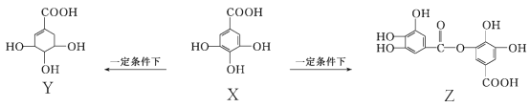
下列说法错误的是
A. 1 mol Z最多能与8 mol NaOH发生反应
B. 1 mol X与H2完全加成产物的分子式为C7H12O5
C. 向Y中滴加FeCl3溶液呈紫色
D. 1 mol Y与足量的金属钠反应放出2 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热的恒容密闭容器中,可逆反应![]() 达到平衡状态的标志是( )
达到平衡状态的标志是( )
①![]() ②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥
②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥![]() ⑦3mol H-H键断裂的同时有2mol N-H键也断裂
⑦3mol H-H键断裂的同时有2mol N-H键也断裂
A.①②③⑤⑥B.②③④⑤⑥
C.②③⑤⑥D.②③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合所学知识回答下列问题:
(1)配制FeCl3水溶液时,常加入少量_____溶液,结合离子方程式解释原因:______。
(2)工业冶炼镁的化学方程式:_____。由氯化镁溶液制备无水氯化镁的操作是_____。
(3)锅炉水垢中的CaSO4可先用Na2CO3溶液浸泡一段时间,放出浸泡液后,再用盐酸处理,用离子方程式表示过程中发生的化学反应:_______、_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A ______ B _____ C _____ D ______
(2)D元素位于周期表中___________周期____________族
(3)写出AB2与C2B2反应的化学方程式:________________________________________。
(4)电子式表示化合物 C2D 的形成过程:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.小苏打溶液与少量澄清石灰水混合:Ca2++OH-+![]() =CaCO3↓+H2O
=CaCO3↓+H2O
B.AlCl3溶液中加入足量的氨水:Al3++4OH-=![]() +2H2O
+2H2O
C.将氯气通入水中:Cl2+H2O=Cl-+ClO-+2H+
D.钠与水反应:2Na + 2H2O = 2Na++ 2OH-+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1所示是高铁电池的模拟实验装置。
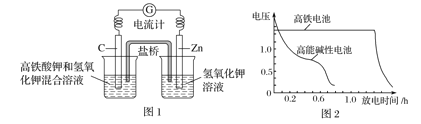
①该电池放电时正极产生红褐色物质,写出正极的电极反应式为_________。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向______(填“左”或“右”)移动;若用阳离子交换膜代替盐桥,则钾离子向________(填“左”或“右”)移动。
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有____________。
(2)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,电池正极的电极反应式是_____,A是________。
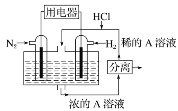
(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如下图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向________(填“从a到b”或“从b到a”),负极发生的电极反应式为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 环已烷与苯可用酸性KMnO4溶液鉴别
B. 在一定条件下,苯与液溴、硝酸、氢气作用生成溴苯、硝基苯、环己烷的反应都属于取代反应
C. 分子式为C8H10O的某芳香化合物有多种结构,其中含有-CH2OH基团的有4种
D. 异丙苯(![]() )中碳原子可能都处于同一平面
)中碳原子可能都处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:

(1)除稀有气体外第三周期中原子半径最小的是_____(填元素符号)
(2)表中用字母标出的12种元素中,化学性质最不活泼的是_____(用元素符号表示,下同),金属性最强的是___(用元素符号表示),属于过渡元素的是___(该空格用表中的字母表示)
(3)元素B的单质含有的化学键为_____。(填“离子键’’、“极性共价键”、“非极性共价键”)
(4)D、F元素最高价氧化物对应水化物相互反应的离子方程式为_____________
(5)为比较元素A和G的非金属性强弱,用图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_________,能说明A和G非金属性强弱的化学方程式是:________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com