
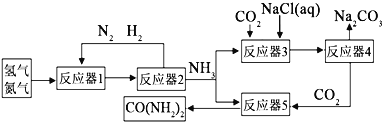
【题目】为了实现资源利用最大化,某化工厂将合成氨、制纯碱和生产尿素![]() 工艺联合,简易流程如下:
工艺联合,简易流程如下:
![]() 时101kPa时,测得生成17g
时101kPa时,测得生成17g![]() ,放出
,放出![]() 热量,写出合成
热量,写出合成![]() 的热化学方程式 ______ .
的热化学方程式 ______ .
![]() 合成氨原料气中的杂质硫化氢用稀氨水吸收,副产品是酸式盐.该副产品的化学式为 ______ .
合成氨原料气中的杂质硫化氢用稀氨水吸收,副产品是酸式盐.该副产品的化学式为 ______ .
![]() 反应器2分离出来的氮气和氢气再通入反应器1,其目的是 ______
反应器2分离出来的氮气和氢气再通入反应器1,其目的是 ______ ![]() 向反应器3充入原料的顺序是:先加氯化钠溶液,通入氨气至饱和,再通入足量的二氧化碳可制得
向反应器3充入原料的顺序是:先加氯化钠溶液,通入氨气至饱和,再通入足量的二氧化碳可制得![]() 反应器3中的化学方程式为 ______ .
反应器3中的化学方程式为 ______ .
![]() 工业上可用碳、甲烷与水蒸汽反应制氢气
工业上可用碳、甲烷与水蒸汽反应制氢气
![]() ,
,![]() ,此反应的化学平衡常数表达式为
,此反应的化学平衡常数表达式为![]() ______ ,为了提高碳的转化率,宜采用下列措施中的
______ ,为了提高碳的转化率,宜采用下列措施中的![]() 填字母编号
填字母编号![]() ______ .
______ .
A.增大压强![]() 增加碳的量
增加碳的量![]() 升高温度
升高温度![]() 增加水的量
增加水的量![]() 使用催化剂
使用催化剂![]() 及时移出CO、
及时移出CO、![]()
![]() 有些国家水电丰富,采用惰性电极电解硫酸钠溶液制氢气,电解时阳极上的电极反应式为 ______ .
有些国家水电丰富,采用惰性电极电解硫酸钠溶液制氢气,电解时阳极上的电极反应式为 ______ .
![]() 若仅以
若仅以![]() 、空气、
、空气、![]() 为原料制尿素
为原料制尿素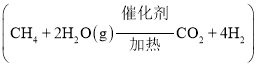 ,标准状况下
,标准状况下![]()
![]() ,理论上最多能制 ______
,理论上最多能制 ______ ![]() 尿素.
尿素.
【答案】![]()
![]() 提高原料利用率
提高原料利用率 ![]()
![]() CDF
CDF ![]() 60
60
【解析】
![]() 和
和![]() 完全反应生成17g即
完全反应生成17g即![]() 放热
放热![]() 热量,生成2mol氨气放热
热量,生成2mol氨气放热![]() ,反应为放热反应,反应的焓变为
,反应为放热反应,反应的焓变为![]() ,依据热化学方程式书写得到;
,依据热化学方程式书写得到;
![]() 硫化氢与氨水反应生成
硫化氢与氨水反应生成![]() ;
;
![]() 氮气和氢气再通入反应器1可节约燃料;氯化钠、氨气和二氧化碳可反应生成碳酸氢钠和氯化铵;
氮气和氢气再通入反应器1可节约燃料;氯化钠、氨气和二氧化碳可反应生成碳酸氢钠和氯化铵;
![]() 平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;为提高某一反应物的转化率,应使平衡向正反应反应方向移动;
平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;为提高某一反应物的转化率,应使平衡向正反应反应方向移动;
![]() 电解硫酸钠溶液实质是电解水;
电解硫酸钠溶液实质是电解水;
![]() 由C原子守恒可知,
由C原子守恒可知,![]() ,以此计算.
,以此计算.
![]() 和
和![]() 完全反应生成17g即
完全反应生成17g即![]() 放热
放热![]() 热量,生成2mol氨气放热
热量,生成2mol氨气放热![]() ,反应为放热反应,反应的焓变为
,反应为放热反应,反应的焓变为![]() ,反应的热化学方程式为:
,反应的热化学方程式为:![]() ;
;
故答案为:![]() ;
;
![]() 硫化氢与氨水反应生成
硫化氢与氨水反应生成![]() ,故答案为:
,故答案为:![]() ;
;
![]() 氮气和氢气再通入反应器1可节约燃料,提高原料利用率;氯化钠、氨气和二氧化碳可反应生成碳酸氢钠和氯化铵:
氮气和氢气再通入反应器1可节约燃料,提高原料利用率;氯化钠、氨气和二氧化碳可反应生成碳酸氢钠和氯化铵:![]() ,
,
故答案为:提高原料利用率;![]() ;
;
![]() 平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积积,所以
平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积积,所以![]() ;为提高碳的转化率,应是反应向正反应方向移动,则可采取的措施有:升高温度、增加水的量、及时分离出CO、
;为提高碳的转化率,应是反应向正反应方向移动,则可采取的措施有:升高温度、增加水的量、及时分离出CO、![]() ,
,
故答案为:![]() ;CDF;
;CDF;
![]() 电解硫酸钠溶液实质是电解水,阳极反应式为
电解硫酸钠溶液实质是电解水,阳极反应式为![]() ,故答案为:
,故答案为:![]() ;
;
![]() 的物质的量是1000mol,由C原子守恒可知,
的物质的量是1000mol,由C原子守恒可知,![]() ,
,![]() 的物质的量是1000mol,质量60000g,即60kg,故答案为:60.
的物质的量是1000mol,质量60000g,即60kg,故答案为:60.


科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g) +D(g)发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是
C(g) +D(g)发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是
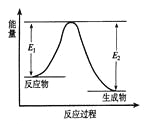
A. 反应体系中加入催化剂,反应速率增大,E1减小,E2增大
B. 反应体系中加入催化剂,反应速率增大,△H不变
C. △H < 0,反应达到平衡时,升高温度,A的转化率增大
D. △H > 0,反应达到平衡时,升高温度,A的转化率减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.6kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g) 2CH3OH(g) △H2=+23.4kJ/mol
反应Ⅲ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H3
(1)△H3=__________kJ/mol。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应Ⅰ。下列描述能说明反应Ⅰ达到平衡状态的是_____________(填序号).
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子中断裂2NA个H-O键,同时氢分子中断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应Ⅱ在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:

此时,v正_________v逆 (填“>”、“<”或“=”),当反应达到平衡时,混合气体中CH3OH体积分数(CH3OH)%=_________%。
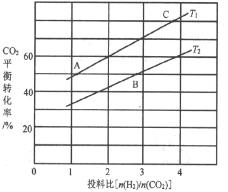
(4)反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入2L的密闭容器中,5 min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=________;平衡常数K=_____(保留小数点后一位);KA、KB、KC三者之间的由大到小关系为______。
(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅲ,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。其中:CH3OH的选择性=![]() ×100%
×100%
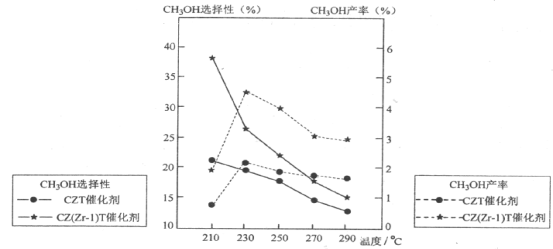
①温度高于230°C,CH3OH产率随温度升高而下降的原因是_______________。(答一条即可)
②在上述条件下合成甲醇的工业条件是___________________。
A.210°C B.230°C C.催化剂CZT D.催化剂CZ(Zr-1)T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2 是一种重要的杀菌消毒剂,也常用来漂白织物等,一种生产NaClO2 的工艺如下:

已知:①ClO2是一种强氧化性气体,浓度大时易分解爆炸。在生产使用时要用稀有气体或空气等进行稀释,同时避免光照、震动等。②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·33H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。回答下列问题:
(1)最近科学家又在“反应”步骤的基础上研究出用H2C2O4代替SO2制备ClO2的新方法,该方法的化学方程式为______________________。
(2)获得产品NaClO2的“操作”包括以下步骤:
①减压,55℃蒸发结晶;②趁热过滤;③___________________________④低于60℃干燥,得到产品。
(3)为了测定产品NaClO2的纯度,取上述所得产品12.5g溶于水配成1L溶液,取出10.00mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(ClO2-被还原为Cl-杂质不参加反应),加入2~3滴淀粉溶液,用0.25molL﹣1Na2S2O3标准液滴定,达到滴定终点时用去标准液20.00mL,试计算产品NaClO2的纯度_________________________(提示:2Na2S2O3+I2=Na2S4O6+2NaI)
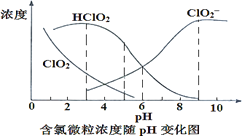
(4)NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-四种含氯微粒。经测定 25℃各含氯微粒浓度随 pH 的变化情况如图所示(Cl-没有画出)
①酸性条件下NaClO2溶液中存在Cl-的原因是_______________________(用离子方程式解释)。
②pH=5时,NaClO2溶液中ClO2、HClO2、ClO2-、Cl-四种含氯微粒的浓度由大到小的顺序是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钛是制取航天航空工业钛合金的重要原料.用钛铁矿![]() 主要成分是钛酸亚铁
主要成分是钛酸亚铁![]() ,含少量
,含少量![]() 、MgO、
、MgO、![]() 等杂质
等杂质![]() 作原料生产金属钛和绿矾
作原料生产金属钛和绿矾![]() 等产品的一种工艺流程如下:已知:Ti有两种价态,在水溶液中主要以
等产品的一种工艺流程如下:已知:Ti有两种价态,在水溶液中主要以![]() 无色
无色![]() 、
、![]() 紫色
紫色![]() 形式存在.
形式存在.

请回答下列问题:
![]() 硫酸与
硫酸与![]() 反应生成
反应生成![]() 的化学方程式是______.
的化学方程式是______.
![]() 滤液1中加入适量铁粉,至刚好出现紫色为止,此时溶液仍呈强酸性.
滤液1中加入适量铁粉,至刚好出现紫色为止,此时溶液仍呈强酸性.
已知:氧化性:![]() 则加入铁粉的作用是______.
则加入铁粉的作用是______.
![]() 滤液2中加入适量的试剂A,可选用______
滤液2中加入适量的试剂A,可选用______![]() 填编号
填编号![]() .
.
![]() 稀
稀![]() 通入
通入![]() 鼓入空气
鼓入空气
![]() 已知
已知![]() ,101kPa时,由二氧化钛制取四氯化钛所涉及的反应有:
,101kPa时,由二氧化钛制取四氯化钛所涉及的反应有:
![]() ,
,
![]() ,
,
![]()
反应![]() ______.
______.
![]() 用石墨作阳极、钛网作阴极、熔融
用石墨作阳极、钛网作阴极、熔融![]() 作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.写出阴极区反应的电极总反应式是______.
作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.写出阴极区反应的电极总反应式是______.

![]() 假如
假如![]() 中的铁元素占矿物中铁元素总量的
中的铁元素占矿物中铁元素总量的![]() ;某次生产中,向滤液1中加入纯铁粉为bkg,得到绿矾晶体的质量为cKg,整个过程中铁元素的总利用率为
;某次生产中,向滤液1中加入纯铁粉为bkg,得到绿矾晶体的质量为cKg,整个过程中铁元素的总利用率为![]() ,Ti元素的转化率为
,Ti元素的转化率为![]() ,其他损失忽略不计.按上述流程,得到
,其他损失忽略不计.按上述流程,得到![]() ______
______![]() 用数字和字母表示
用数字和字母表示![]() 已知:
已知:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为二元弱酸,
为二元弱酸,![]() ,
,![]() ,设
,设![]() 溶液中
溶液中![]() 。室温下用NaOH溶液滴定
。室温下用NaOH溶液滴定![]() 溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
A.![]() 溶液:
溶液:![]()
B.![]() 的溶液:
的溶液:![]()
C.![]() 的溶液:
的溶液:![]()
D.![]() 的溶液:
的溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洗煤和选煤过程中排出的煤矸石(主要含Al2O3、SiO2及Fe2O3)会占用大片土地,造成环境污染。某课题组利用煤矸石制备聚合氯化铝流程如下:

已知:聚合氯化铝([Al2(OH)nCl6-n]m(1≤n≤5,m≤10),商业代号PAC)是一种新型、高效絮凝剂和净水剂。
(1)酸浸的目的是___________________________;实验需要的500mL3.0 mol·L-1的盐酸,配制时所需要的玻璃仪器除量筒、烧杯、玻璃棒外还有______________________。
(2)若m=n=2,则生成PAC的化学方程式是_____________________。
(3)从含PAC的稀溶液中获得PAC固体的实验操作方法是_______、_________、_________。
(4)为了分析残渣2中铁元素的含量,某同学称取5.000g残渣2,先将其预处理使铁元素还原为Fe2+,并在容量瓶中配制成100mL溶液;然后移取25.00mL试样溶液,用1.000×10-2mol·L-1KMnO4标准溶液滴定,消耗标准溶液20.00mL。已知反应式为Fe2++MnO4-+H+—Fe3++Mn2++H2O(未配平)。判断滴定终点的依据是_______________________;残渣2中铁元素的质量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 向淀粉的酸性水解液中滴入少量新制Cu(OH)2悬浊液并加热 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
B | NaAlO2溶液与NaHCO3溶液混合 | 白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 的△H<0 |
D | 向盛有1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1mol/L的NaI溶液,再振荡 | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)sp(AgCl) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向某一元酸HR溶液中滴加一元碱BOH溶液,混合溶液的 或
或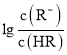 与pH变化的关系如图所示。下列叙述正确的是
与pH变化的关系如图所示。下列叙述正确的是![]()
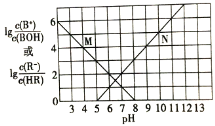
A.M线表示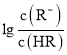 随pH的变化
随pH的变化
B.BR溶液呈碱性
C.若温度升高,两条线均向上平移
D.常温下,![]() 溶液的
溶液的![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com