
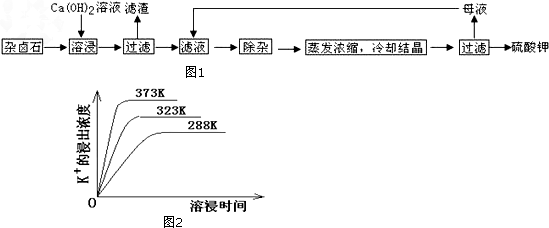
分析 杂卤石在水中存在如下溶解平衡:K2SO4•MgSO4•2CaSO4•2H2O(s)?2 Ca2++2K++Mg2++4 SO42-+2H2O,向杂卤石中加入Ca(OH)2溶液,氢氧根离子和镁离子反应生成更难溶的Mg(OH)2沉淀,钙离子和硫酸根离子浓度达到一定程度时生成CaSO4沉淀,所以得到的滤渣成分是Mg(OH)2、CaSO4和未溶解的杂卤石,滤液中含有Ca2+、K+、OH-、SO42-,向滤液中加入过量K2CO3,除去溶液中的Ca2+,然后再加入稀硫酸除去过量的CO32-,调节溶液的pH得到较纯净的硫酸钾,然后将溶液蒸发浓缩得到硫酸钾晶体,以此解答该题.
解答 解:杂卤石在水中存在如下溶解平衡:K2SO4•MgSO4•2CaSO4•2H2O(s)?2 Ca2++2K++Mg2++4 SO42-+2H2O,向杂卤石中加入Ca(OH)2溶液,氢氧根离子和镁离子反应生成更难溶的Mg(OH)2沉淀,钙离子和硫酸根离子浓度达到一定程度时生成CaSO4沉淀,所以得到的滤渣成分是Mg(OH)2、CaSO4和未溶解的杂卤石,滤液中含有Ca2+、K+、OH-、SO42-,向滤液中加入过量K2CO3,除去溶液中的Ca2+,然后再加入稀硫酸除去过量的CO32-,调节溶液的pH得到较纯净的硫酸钾,然后将溶液蒸发浓缩得到硫酸钾晶体,
(1)通过以上分析知,滤渣成分是Mg(OH)2、CaSO4和未溶解的杂卤石,
故答案为:CaSO4;Mg(OH)2;
(2)加入Ca(OH)2溶液,Ca(OH)2电离生成的氢氧根离子和镁离子反应生成Mg(OH)2沉淀,从而减小镁离子浓度,导致固体溶解,所以K+增多,
故答案为:氢氧根与镁离子结合,使平衡向右移动,K+变多;
(3)除杂环节中,要加入过量的K2CO3除去钙离子、加入稀硫酸除去过量的K2CO3,故答案为:K2CO3;H2SO4;
(4)不同温度下,温度越高K+的浸出浓度越大,溶浸时间越短,反应速率越大,达到平衡越快,故图象中分析得到的结论为:温度越高,在同一时间K+的浸出浓度大;反应速率加快,平衡时溶浸时间短,
故答案为:①在同一时间K+的浸出浓度大;②反应的速率加快,平衡时溶浸时间缩短;
(5)溶浸过程中会发生:CaSO4(s)+CO32-(aq)?CaCO3(s)+SO42-(aq),CaCO3(s)=Ca2++CO32-;CaSO4(s)=Ca2++SO42-;依据硫酸钙、碳酸钙溶度积常数的计算表达式,转化关系中钙离子相同计算,反应的平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{Ksp({C}_{a}S{O}_{4})}{Ksp({C}_{a}C{O}_{3})}$=$\frac{4.90×1{0}^{-5}}{2.80×1{0}^{-9}}$=1.75×104,故答案为:1.75×104.
点评 本题考查物质的分离、提纯,为高考常见题型,题目涉及难溶物的溶解平衡,明确难溶物溶解平衡移动原理是解本题关键,答题时注意会从整体上分析流程中各个步骤发生的反应、操作方法,难点是除杂剂的选取及滴加顺序,题目难度中等.


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

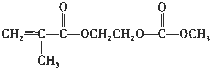 ,写出该单体与足量氢氧化钠溶液反应的化学方程式:
,写出该单体与足量氢氧化钠溶液反应的化学方程式: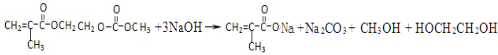 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
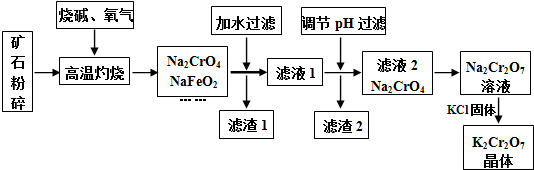
| 时间/(s) | 0 | 0.01 | 0.02 | 0.03 | 0.04 |
| (CrO42-)/(mol•L-1) | 0.20 | 1.6×10-2 | 1.2×10-2 | 1.0×10-2 | |
| (Cr2O72-)/(mol•L-1) | 0 | 9.2×10-2 | 9.4×10-2 | 9.5×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C可用于测定一些文物的年代,该过程是化学变化 | |
| B. | 烧结粘土制陶瓷是物理变化 | |
| C. | 服用阿司匹林出现水杨酸反应时,用碳酸氢钠溶液解毒是复分解反应 | |
| D. | 从海水中提取镁的过程中,发生的是非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L氯仿(CHCl3)含0.4NA个共价键 | |
| B. | 1molNaHSO4固体含3NA个离子 | |
| C. | NA个H2分子与NA个I2(g)分子反应生成HI(g),反应后容器中含2NA个分子 | |
| D. | 反应:K35ClO3+6H37Cl═3Cl2↑+KCl+3H2O,当有71gCl2生成时,转移0.5NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
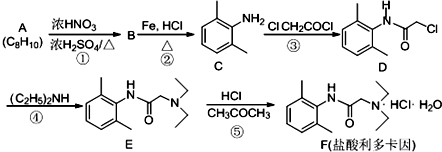
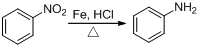
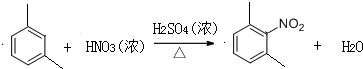 ,反应类型为取代反应,上述流程中,反应类型与①相同的还有③④(填反应序号).
,反应类型为取代反应,上述流程中,反应类型与①相同的还有③④(填反应序号). (R为烃基)
(R为烃基)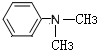 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
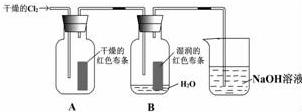 某同学设计了如图的实验:
某同学设计了如图的实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com