
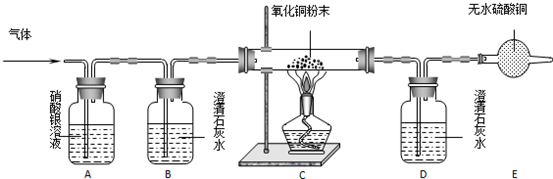
| 装置编号 | A | B | C | D | E |
| 试 剂 | 硝酸银溶液 | 澄清石灰水 | 氧化铜粉末 | 澄清石灰水 | 无水硫酸铜 |
| 现 象 | 无明显变化 | 变浑浊 | 变红色 | 无明显变化 | 变蓝色 |


科目:高中化学 来源: 题型:
| 压强/MPa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:反应①Fe(s)+CO2(g)?FeO(s)+CO(g);△H=Q1,平衡常数为K1,
已知:反应①Fe(s)+CO2(g)?FeO(s)+CO(g);△H=Q1,平衡常数为K1,| T(K) | K1 | K2 |
| 700 | 1.47 | 2.38 |
| 900 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、第35min时,NO2的体积分数高于第15min时的体积分数 |
| B、T℃时,N2O4(g)?2NO2(g)的平衡常数为0.9 |
| C、a、b、C、d四点中,气体颜色最浅的是C点 |
| D、0~10min内反应体系对外界放热,25~30min内反应体系从外界吸热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com