
在下述条件下,一定能大量共存的离子组是( )。
A.无色透明的水溶液中:K+、Ba2+、Cl-、MnO4-
B.含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+
C.滴入酚酞试剂显红色的溶液中:Na+、K+、CO32-、Br-
D.强碱性溶液中:ClO-、S2-、HSO3-、Na+
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014年高考化学题型冲刺练习 化学基本概念、解决化学与STSE问题(解析版) 题型:选择题
判断下列有关化学基本概念的依据不正确的是( )
A.溶液与胶体:能否发生丁达尔效应
B.氧化还原反应:元素化合价是否变化
C.强弱电解质:在水溶液或熔融状态下能否完全电离
D.共价化合物:是否含有共价键
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版专练3限定条件离子共存及离子方程式书写练习卷(解析版) 题型:选择题
下列解释事实的离子方程式不正确的是( )。
A.氨水使酚酞溶液变红:NH4++H2O NH3·H2O+H+
NH3·H2O+H+
B.醋酸使碳酸钙溶【解析】
CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
C.草酸溶液使酸性高锰酸钾溶液褪色:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
D.向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版专练3限定条件离子共存及离子方程式书写练习卷(解析版) 题型:选择题
下列离子方程式表示正确的是( )。
A.往FeI2溶液中通入过量氯气:Cl2+2Fe2+=2Cl-+2Fe3+
B.将明矾溶于水中生成胶体:Al3++3H2O??Al(OH)3(胶体)+3H+
C.大理石溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版专练3限定条件离子共存及离子方程式书写练习卷(解析版) 题型:选择题
某溶液中存在XO-,且X为短周期元素,则一定能在该溶液中大量共存的离子组是( )。
A.Na+、H+、SO42-、I- B.Na+、Ca2+、CO32-、Al3+
C.Na+、K+、Fe2+、H+ D.K+、SO42-、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练4 无机化工流程题专项突破练习卷(解析版) 题型:填空题
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
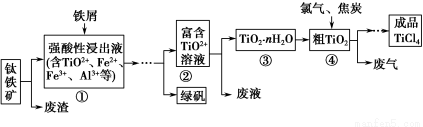
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+??Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用 方法。
| TiCl4 | SiCl4 |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练2 阿伏加德罗常数的判断练习卷(解析版) 题型:选择题
NA代表阿伏加德罗常数。下列叙述正确的是( )。
A.标准状况下,22.4 L己烷中C—C共价键数目为5NA
B.0.1 mol·L-1 AlCl3溶液中含有氯离子数为0.3NA
C.1 mol Fe在1 mol Cl2中充分燃烧,转移电子数为3NA
D.20 g重水(12H2O)所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第1章 化学反应与能量转化练习卷(解析版) 题型:选择题
通常人们把拆开1 mol某化学键所吸收的能量或形成1 mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热(ΔH),已知
化学健 | H-H | Cl-Cl | H-Cl |
键能 | 436 kJ·mol-1 | 243 kJ·mol-1 | 431 kJ·mol-1 |
则下列热化学方程式不正确的是( )
A. H2(g)+
H2(g)+ Cl2(g)=HCl(g)ΔH=-91.5 kJ·mol-1
Cl2(g)=HCl(g)ΔH=-91.5 kJ·mol-1
B.H2(g)+Cl2(g)=2HCl(g)ΔH=-183 kJ·mol-1
C. H2(g)+
H2(g)+ Cl2(g)=HCl(g)ΔH=91.5 kJ·mol-1
Cl2(g)=HCl(g)ΔH=91.5 kJ·mol-1
D.2HCl(g)=H2(g)+Cl2(g)ΔH=183 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com