
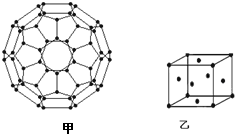
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.分析 (1)28号元素镍,核外有28个电子,根据构造原理写出其基态镍原子的核外电子排布式,根据价电子排布式确定分区;
(2)根据价层电子对互斥理论确定杂化方式,利用均摊法计算每个碳原子含有几个σ键,从而计算1mol C60分子中σ键的数目;
(3)①同一周期元素的第一电离能随着原子序数的增大而增大,但第VA族元素第一电离能大于第VIA元素;
②根据价层电子对互斥理论确定其空间构型;
(4)F的电负性大于N,形成的氢键强度F-H>N-H,因此HF的沸点大于NH3的沸点;NH4F是由NH4+和F-构成的离子化合物,属于离子晶体;N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子;根据均摊法计算晶胞中Cu原子数目,结合相对分子质量及阿伏伽德罗常数表示出晶胞质量,根据晶胞棱长计算晶胞体积,再根据密度计算晶胞质量,据此列方程计算.
解答 解:(1)28号元素镍,核外有28个电子,根据构造原理知其基态镍原子的核外电子排布式的简化形式为[Ar]3d84s2,因此基态镍原子的外围电子排布式为3d84s2,位于周期表d区,
故答案为:3d84s2;d;
(2)每个碳原子含有的σ键个数且不含孤电子对,所以采用sp2 杂化,每个碳原子含有的σ键个数为$\frac{3}{2}$,所以1mol C60分子中σ键的数目=$\frac{3}{2}$×60NA=90NA,
故答案为:sp2;90NA;
(3)①As和Se属于同一周期,且As属于第VA族,Se属于第VIA族,所以第一电离能As>Se,
故答案为:>;
②二氧化硒分子中价层电子对=2+$\frac{1}{2}$(6-2×2)=3,且含有一个孤电子对,所以属于V形,
故答案为:V形;
(4)F的电负性大于N,形成的氢键强度F-H>N-H,因此HF的沸点大于NH3的沸点;NH4F是由NH4+和F-构成的离子化合物,属于离子晶体;
N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子;
晶胞中含有铜原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为$\frac{4×64}{N{\;}_{A}}$g,该晶胞体积为a3 pm3,则$\frac{4×64}{N{\;}_{A}}$g=a3 pm3×ρ g/cm3,故NA=$\frac{256×10{\;}^{30}}{ρa{\;}^{3}}$,
故答案为:<;离子;F的电负性大于N,NF3中,共用电子对偏向F,偏离N原子,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键;=$\frac{256×10{\;}^{30}}{ρa{\;}^{3}}$;
点评 本题是对物质结构的考查,涉及核外电子排布式、电离能、分子结构、杂化轨道、配合物、晶胞计算等,难度中等,注意利用均摊法进行晶胞有关计算,理解同周期第一电离能突跃原因.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2具有还原性,故可作漂白剂 | |
| B. | Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg | |
| C. | HClO见光会分解,故氯水保存在棕色试剂瓶中 | |
| D. | Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中的Fe也显+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中逐滴加入氨水,产生白色沉淀后消失 | |
| B. | 向Na2SiO3溶液中逐滴加入稀盐酸,产生白色胶状沉淀 | |
| C. | 钠与氧气在加热条件下反应,生成白色固体 | |
| D. | 将砂纸打磨过的铝箔加热至熔化,熔化的铝以小液滴的形式滴落下来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点/℃ | 56.2 | 77.06 | 78 | 117.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
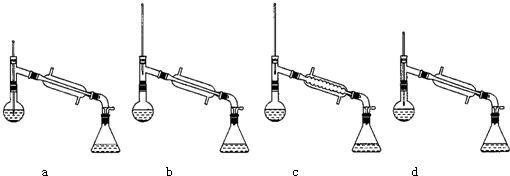
 如图是中学化学实验中出现频率较高的装置,它是由物质制备、生成物性质检验和尾气处理三部分组成.请你用中学化学常见试剂设计一个实验.通过乙中的反应和丙中的实验现象,得出三种物质性质递变的结论.试将试剂名称、丙中的实验现象及由此得出的实验结论填入下列空白处.
如图是中学化学实验中出现频率较高的装置,它是由物质制备、生成物性质检验和尾气处理三部分组成.请你用中学化学常见试剂设计一个实验.通过乙中的反应和丙中的实验现象,得出三种物质性质递变的结论.试将试剂名称、丙中的实验现象及由此得出的实验结论填入下列空白处.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀硫酸反应时,加入少量醋酸钠,则反应速率降低 | |
| B. | 醋酸比硫酸对衣服的腐蚀性差 | |
| C. | 0.1 mol•L-1醋酸钠溶液的pH约为9 | |
| D. | 用NaOH溶液中和等体积,相同pH的盐酸和醋酸,盐酸消耗NaOH溶液的体积小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用,所以用铝制容器存放盐酸 | |
| B. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| D. | 铝既可以与强酸反应又可以与强碱反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com