
 2016年12月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.
2016年12月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
分析 (1)①A.在单位时问内生成1mol CO2的同时消耗了1mol CO,从反应开始到平衡,都符合这等量关系;
B.混合气体的密度不再改变,体积不变,反应体系都是气体,从反应开始到平衡,密度始终不变;
C.混合气体的平均相对分子质量不再改变,说明各物质的物质的量不变,达平衡状态;
D.混合气体的压强不再变化,说明各物质的物质的量不变,达平衡状态;
②将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,相当于减小压强,正逆反应速率都比原来的小,平衡逆向移动,所V正<V逆;
③若要同时提高该反应的速率和NO的转化率,外界条件增强,平衡正向移动;
(2)①根据△G=△H-T△S判断,△G<0,反应自发进行;
②根据碳酸和氢硫酸的两步电离平衡常数进行比较氢硫酸与碳酸、碳酸氢根离子离子酸性大小,从而得出反应产物,写出反应的离子方程式;
(3)①第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时H2的物质的量比第一组的一半少,表明该反应为放热反应;依据图表数据列式计算平衡浓度,如果a=b两者的转化率相等,CO的转化率大于水蒸气,相当于加入水蒸气,平衡正向移动;
③依据浓度商和平衡常数比较分析判断.
解答 解:(1)①A.在单位时问内生成1mol CO2的同时消耗了1mol CO,从反应开始到平衡,都符合这等量关系,故A不选;
B.混合气体的密度不再改变,体积不变,反应体系都是气体,从反应开始到平衡,密度始终不变,故B不选;
C.混合气体的平均相对分子质量不再改变,说明各物质的物质的量不变,达平衡状态,故C选;
D.混合气体的压强不再变化,说明各物质的物质的量不变,达平衡状态,故D选;
故答案为:CD;
②将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,相当于减小压强,正逆反应速率都比原来的小,平衡逆向移动,所V正<V逆,故图象为: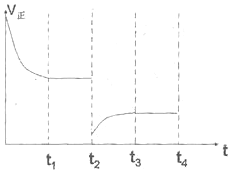 ,故答案为:
,故答案为: ;
;
③若要同时提高该反应的速率和NO的转化率,外界条件增强,平衡正向移动,措施是增大压强或向容器中充入CO气体,
故答案为:增大压强或向容器中充入CO气体;
(2)①由热化学反应方程式可知,该反应为焓增、熵增过程,即△H>0、△S>0,必须满足△G=△H-T△S<0反应才能自发进行,所以在高温下能够自发进行,
故答案为:高温;
②由于Ka2=5.61×10-11<Ka1=9.1×10-8<Ka1=4.30×10-7、Ka2=5.61×10-11>Ka2=1.1×10-12,所以氢硫酸能够与碳酸钠溶液反应生成碳酸氢钠和硫氢化钠,反应的离子方程式为:CO32-+H2S=HCO3-+HS-,
故答案为:CO32-+H2S=HCO3-+HS-;
(3)①如果a=b两者的转化率相等,CO的转化率大于水蒸气,相当于加入水蒸气,平衡正向移动,则a<b,
故答案为:a<b;
②由实验2计算平衡常数,
H2O(g)+CO(g)?CO2(g)+H2(g)
初始 0.5mol/L 1mol/L 0 0
转化 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
平衡 0.3mol/L 0.8mol/L 0.2mol/l 0.2mol/l
K=$\frac{0.2×0.2}{0.3×0.8}$=0.167,按10mol C0,5mol H20,2mol C02,5mol H2加入该容器,
Qc=$\frac{\frac{2}{2}×\frac{5}{2}}{\frac{10}{2}×\frac{5}{2}}$=0.2>K
反应逆向进行,v(正)<v(逆),
故答案为:<.
点评 本题考查化学平衡和化学反应速率等知识,做题时注意把握影响平衡移动的因素以及平衡常数的有关计算,此为化学平衡常考查问题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 选项化合物 | A | B | C | D |
| Y | CO2 | Fe2O3 | SiO2 | FeCl3 |
| W | MgO | Al2O3 | Si | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原子半径:Z>Y>X | |
| B. | R元素的氧化物对应水化物和W元素的氧化物对应水化物,酸性前者强 | |
| C. | X和Z形成的化合物能溶于NaOH溶液 | |
| D. | Y和X形成的化合物中,阴阳离子的个数比可能为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2固体与62gNa2O固体中阴、阳离子总数均为3NA | |
| B. | 在2H2O+2Na2O2=4NaOH+O2↑的反应中,当产生标况下5.6LO2时,转移的电子数为NA | |
| C. | 1mol SiO2分子中含NA个Si原子和2NA个氧原子 | |
| D. | 54g铝与足量的稀硝酸反应产生的氢气分子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com