
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
方法a:用炭粉在高温条件下还原CuO
方法b:电解法,反应为2Cu+H2O![]() Cu2O+H2↑
Cu2O+H2↑
(1)已知:①2Cu(s)+1/2O2(g)=Cu2O(s) △H=-169kJ/mol
②C(s)+1/2O2(g)=CO(g) △H=-110.5kJ/mol
③Cu(s)+1/2O2(g)=CuO(s) △H=-157kJ/mol
则方法a中反应的热化学方程式是:_________________。
(2)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:

① 上述装置中B电极应连______电极(填“℃”或“D”)
② 该离子交换膜为_______离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为:______。
③ 原电池中负极反应式为:_______________。
(3)在相同体积的恒容密闭容器中,用以上方法制得的两种Cu2O分别进行催化分解水的实验:
2H2O![]() 2H2(g)+O2(g) △H>0
2H2(g)+O2(g) △H>0
水蒸气的浓度随时间t变化如下表所示:

①催化剂的效率:实验①_______实验②(填“>”或“<”);
② 实验①、②、③的化学平衡常数K1、K2、K3的大小关系为:_______。
【答案】 2CuO(s)+C(s)=Cu2O(s)+CO(g) ΔH=+34. 5kJ/mol D 阴 2Cu-2e-+2OH-= Cu2O+H2O N2H4-4e—+4OH-=N2↑+4H2O < K1=K2<K3
【解析】(1)①2Cu(s)+ ![]() O2(g)═Cu2O(s)△H=-169kJmol-1;②C(s)+
O2(g)═Cu2O(s)△H=-169kJmol-1;②C(s)+ ![]() O2(g)═CO(g)△H=-110.5kJmol-1;③2Cu(s)+O2(g)═2CuO(s)△H=-314kJmol-1;
O2(g)═CO(g)△H=-110.5kJmol-1;③2Cu(s)+O2(g)═2CuO(s)△H=-314kJmol-1;
依据盖斯定律②+①-③得到:C(s)+2CuO (s)=CuO(s)+CO(g)△H=+34.5kJmol-1;
(2)①铜失电子发生氧化反应,为电解池的阳极,故B连接电源的正极,而燃烧电池通氧气的极为正极,则B连接D;
②电解池工作时,OH-向阳极移动,则离子交换膜为阴离子交换膜;在电解池中,当阳极是活泼电极时,该电机本身发生失电子得还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O;
③原电池的负极发生氧化反应,其电极反应为 N2H4-4e—+4OH-=N2↑+4H2O;
(3)催化剂不会引起化学平衡状态的改变,会使反应速率加快,反应②比反应①达到平衡所用时间短,平衡状态相同,反应速率快,所以①<②,实验温度越高达到化学平衡时水蒸气转化率越大,②和③相比,③转化率高,所以T2>T1;平衡常数只受温度影响,且升高温度平衡正向移动,则实验①、②、③的化学平衡常数K1、K2、K3的大小关系为K1=K2<K3。


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】碳是地球上组成生命的最基本元素之一,可以sp3 、sp2和sp杂化轨道成共价键,具有很强的结合能力,与其它元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态碳原子核外有__________种空间运动状态的电子,其价电子排布图为 。
(2)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为 ,其碳原子杂化轨道类型为 杂化。
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:

试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?
(4)碳的一种同素异形体——C60,又名足球烯,是一种高度对称的球碳分子。立方烷(分子式:C8H8,结构是立方体:![]() )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
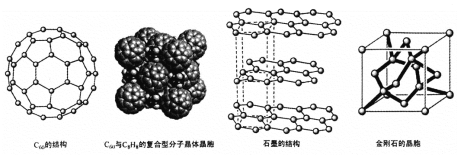
(5)碳的另一种同素异形体——石墨,其晶体结构如上图所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为 个。已知石墨的密度为ρg.cm-3 ,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为 cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用浓度为0.100 mol·L-1的NaOH溶液分别逐滴加入到20.00 mL 0.100 0 mol·L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图。下列说法正确的是( )

A. V(NaOH)=10.00 mL时,两份溶液中c(X-)>c(Y-)
B. V(NaOH)=10.00 mL时,c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
C. V(NaOH)=20.00 mL时,c(OH-)>c(H+)>c(Na+)>c(X-)
D. pH=7时,两份溶液中c(X-)=c(Na+)=c(Y-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法不正确的是( )
A. 1mol乙醇可以与足量金属钠反应,生成0.5molH2,能证明乙醇分子有一个H原子与其余的H原子不同
B. 下列反应可证明苯环受甲基的影响,甲苯易被酸性高锰酸钾氧化![]()
C. 下列反应可证明由于羟基对苯环的影响,导致苯酚的取代比苯容易
D. 苯不能使溴的四氯化碳溶液褪色可以说明苯分子中没有与乙烯分子中类似的碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M、N、Q的转化关系为,下列说法正确的是( )
![]()
A. M至N的反应类型是取代反应 B. N的同分异构体有6种
C. 可用酸性KMnO4溶液区分N与Q D. 0.3molQ与足量金属钠反应生成0.15NA个H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com