
【题目】碱式碳酸铜可用于有机催化剂、杀虫剂及饲料中铜的添加剂,还可用于烟火和颜料制造。CuSO4溶液与Na2CO3溶液反应能否得到碱式碳酸铜?某班同学进行相关探究。
【沉淀制备】
称取12.5 g胆矾溶于87.4 mL蒸馏水中,滴4滴稀硫酸,充分搅拌后得到CuSO4溶液。向其中加入适量Na2CO3溶液,将所得蓝绿色悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
(1)滴加稀硫酸的作用是 。所得硫酸铜溶液的溶质质量分数为 。
(2)用无水乙醇洗涤的目的是 。
【实验探究】
同学们设计了如下装置,用制得的蓝绿色固体进行实验:
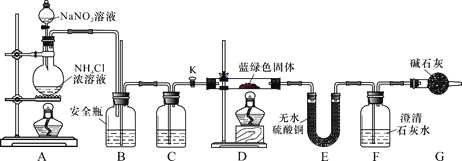
(3)D装置加热前,需要首先打开活塞K,用A装置制取适量N2,然后关闭K,点燃D处酒精灯。A中产生N2的作用是 ,C中盛装的试剂应是 。
(4)装置A中发生反应的离子方程式为 。
(5)若蓝绿色固体的组成为xCuCO3·yCu(OH)2,实验能观察到的现象是 。
(6)同学们查阅文献知:Ksp[CaCO3]=2.8×10-9,Ksp[BaCO3]=5.1×10-9,经讨论认为需要用Ba(OH)2代替Ca(OH)2来定量测定蓝绿色固体的化学式,其原因是 。
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是 。若定量分析所取蓝绿色固体质量为27.1 g,装置F中使用Ba(OH)2溶液,实验结束后,装置E的质量增加2.7 g,F中产生沉淀19.7 g。则该蓝绿色固体的化学式为 。
【答案】(1)抑制Cu2+水解,防止溶液变浑浊(1分) 8.0%(1分)
(2)利用乙醇易挥发的性质带走沉淀上面的水(1分)
(3)排除装置中的空气,避免干扰(1分) 浓硫酸(1分)
(4)NO2-+NH4+![]() N2↑+2H2O(2分)
N2↑+2H2O(2分)
(5)硬质玻璃管中蓝绿色固体变黑色,E中白色固体变蓝,F中溶液变浑浊(2分)
(6)b d(2分) 让停留在装置中的气体被充分吸收,减小实验误差(1分)
2CuCO33Cu(OH)2或3Cu(OH)22CuCO3或Cu5(OH)6(CO3)2(2分)
【解析】试题分析:(1)铜离子水解,因此滴加稀硫酸的作用是抑制Cu2+水解,防止溶液变浑浊。所得硫酸铜溶液的溶质质量分数为![]() 8.0%。
8.0%。
(2)乙醇和水互溶,易挥发,所以用无水乙醇洗涤的目的是利用乙醇易挥发的性质带走沉淀上面的水。(3)装置内有残留的空气,所以A中产生N2的作用是排除装置中的空气,避免干扰;生成的氮气中含有水蒸气,会干扰后续实验,所以C中盛装的试剂应是浓硫酸,除去氮气中的水蒸气。
(4)装置A中发生反应的离子方程式为NO2-+NH4+![]() N2↑+2H2O。
N2↑+2H2O。
(5)若蓝绿色固体的组成为xCuCO3·yCu(OH)2,因此受热分解生成氧化铜、CO2和水蒸气,则实验能观察到的现象是硬质玻璃管中蓝绿色固体变黑色,E中白色固体变蓝,F中溶液变浑浊。
(6)由于Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2,吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小,所以需要用Ba(OH)2代替Ca(OH)2来定量测定蓝绿色固体的化学式。待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是让停留在装置中的气体被充分吸收,减小实验误差。若定量分析所取蓝绿色固体质量为27.1 g,装置F中使用Ba(OH)2溶液,实验结束后,装置E的质量增加2.7 g,即水蒸气是2.7g,物质的量是0.15mol。F中产生沉淀19.7 g,即碳酸钡是19.7g,物质的量是0.1mol,因此x:y=2:3,则该蓝绿色固体的化学式为2CuCO33Cu(OH)2。


科目:高中化学 来源: 题型:
【题目】具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-![]() FeO42-+3H2↑,其工作原理如图所示。下列叙述正确的是
FeO42-+3H2↑,其工作原理如图所示。下列叙述正确的是

A.电解一段时间后,阳极室的c(OH-)增大
B.Na+由阴极室移向阳极室
C.阴极反应式:2H2O+2e-=H2↑+2OH-
D.电解过程中,当消耗1 mol OH-时,同时生成33.6 L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①水和植物油的混合物 ②提取白酒中的乙醇 ③氯化钠和单质溴的混合液。分离以上各混合液的正确方法依次( )
A、分液、萃取、蒸馏 B、萃取、蒸馏、分液
C、分液、蒸馏、萃取 D、蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据图1和图2所示,回答下列问题:

图1
(1)Y的化学式为__________________
(2)欲制备Na2S2O3,从氧化还原角度分析,合理的是______________(填序号)。
a.Na2S +S b.Na2SO3+S c.Na2SO3+Na2SO4 d.SO2+Na2SO4
(3)将X与O2混合,可生成淡黄色固体。该反应的氧化剂与还原剂物质的量之比为_____________。
(4)图2为铜丝与W的浓溶液反应并验证其产物性质的实验装置。

图2
Ⅰ.①中反应的化学方程式是_____________。想要立即终止①的反应,最恰当的方法是__________。
a.上移铜丝,使其脱离溶液 b.撤去酒精灯 c.拔去橡胶塞倒出溶液
Ⅱ.④中棉花团的作用是_________________。
Ⅲ.反应停止后,待装置冷却,把③取下后向其中加入氯水,观察到白色沉淀生成,写出相关反应的离子方程式_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中常用到0.1 mol/L的NaOH溶液,其中的“mol/L”对应的物理量是
A. 溶解度 B. 质量分数 C. 摩尔质量 D. 物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某简易净水器如右图所示。下列说法中,正确的是
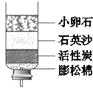
A. 净水过程中发生了化学变化
B. 该净水器能杀菌消毒
C. 活性炭的主要作用是吸附杂质
D. 净化后的水属于纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4用途广泛,以Cu为原料制CuSO4有多种方法。
(1)实验室可用Cu与浓硫酸反应制CuSO4。
① Cu与浓硫酸反应的化学方程式是________。
② 该方法制CuSO4存在的不足是________(写出任意一条)。
(2)实验小组采取如下方法制CuSO4。

实验表明,Fe3+能加快生成CuSO4的反应速率,加快原理可表述为:
i. 2Fe3+ + Cu = 2Fe2+ + Cu2+
ii. ……
ii的离子方程式是________。
(3)用电解的方法制CuSO4,如图所示。

① 与直流电源a 端相连的电极材料是________(填“铜片”或“石墨”)。
② 将进口处较浓硫酸替换为Na2SO4溶液进行实验,发现得到的CuSO4溶液pH比替换前升高,结合化学用语解释pH升高的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析离子反应 xR2++yH++O2═mR3++nH2O,下列说法中正确的是( )
A.n=2,H2O是氧化产物
B.x=y=m=4
C.该反应中R2+得到电子,被氧化为R3+
D.任何氧化还原反应中氧化剂失电子总数都等于还原剂得电子总数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com