
分析 (1)所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为N2O,硫酸亚铁中二价铁离子被氧化生成三价铁离子,为还原剂,对应氧化产物为硫酸铁和硝酸铁,根据氢原子守恒,水在生成物中,根据化合价升降相等和原子守恒配平后发生的反应,据此解答;
(2)反应物中所含元素化合价升高的物质被氧化;所含元素化合价降低的被还原;
(3)根据化合价变化数目计算1mol氧化剂发生还原时转移电子数.
解答 解:所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为N2O,硫酸亚铁中二价铁离子被氧化生成三价铁离子,为还原剂,对应氧化产物为硫酸铁和硝酸铁,依据原子个数守恒、得失电子守恒可知,该反应的化学方程式:30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O,
故答案为:30HNO3;24FeSO4;8Fe(NO3)3;8Fe2(SO4)3;3N2O;15H2O;
(2)依据方程式:30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O,可知:硫酸亚铁中的二价铁离子化合价升高,所以硫酸亚铁被氧化;
硝酸中N元素化合价,被还原;
故答案为:FeSO4;N;
(3)30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O,硝酸为氧化剂,由方程式可知:
HNO3~0.5N2O~转移电子数4,
1mol 4mol;
故答案为:4.
点评 本题考查了化学方程式书写,侧重考查氧化还原方程式的书写,依据物质的性质及氧化还原反应的强弱规律判断反应物与生成为解题关键,注意对基本概念的掌握.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 32g S2-中电子数目为2NA | |
| B. | 46g NO2和N2O4的混合物中含有的原子数为3NA | |
| C. | 1L 0.5mol•L-1 Na2CO3溶液中含有的CO32-数为0.5NA | |
| D. | 78g Na2O2中阴离子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3提供孤对电子 | |
| C. | 沉淀溶解后将生成深蓝色的正四面体形的配离子[Cu(NH3)4]2+ | |
| D. | 加入极性较小的溶剂乙醇后,将析出[Cu(H2O)4]SO4•H2O晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SO3都是极性分子 | |
| B. | 在H3O+和[Cu(H2O)4]2+中都存在配位键 | |
| C. | 元素电负性越大的原子,该元素的原子吸引键合电子的能力越强 | |
| D. | 原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键是一种作用力 | |
| B. | 化学键可以使离子相结合,也可以使原子相结合 | |
| C. | 一种物质只含两种非金属元素,该物质中一定没有非极性供价键 | |
| D. | 氢键属于分子间作用力,不属于化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水不能鉴别苯和溴苯 | |
| B. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 | |
| C. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| D. | 某有机物的分子结构如图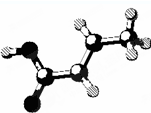 (图中棍表示单键、双键或叁键),它属于烃的含氧衍生物,该有机物可发生取代反应和加成反应 (图中棍表示单键、双键或叁键),它属于烃的含氧衍生物,该有机物可发生取代反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体时,应往沸水中逐滴加lmol•L-l的FeCl3溶液,并继续加热到液体呈透明的红褐色为止 | |
| B. | 加热NH4Cl晶体时,用湿润的红色石蕊试纸靠近试管口,检验NH3的生成 | |
| C. | 将金属钠在研钵中研成粉末,使钠与水反应的实验更安全 | |
| D. | 用托盘天平准确称取5.85g NaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4.6 g NO2气体约含有1.81×1023个原子 | |
| B. | 在标准状况下,80 gSO3所占的体积约为22.4L | |
| C. | 常温下,0.1 mol/L醋酸溶液的pH约为1 | |
| D. | 标准状况下,22.4L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com