
| A. | 过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| C. | 酸性条件下,向含铬废水中加入FeSO4,可将Cr2O72-还原为Cr3+:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
分析 A.反应生成亚硫酸氢钠;
B.碘化氢过量,铁离子和硝酸根离子都完全反应,漏掉了硝酸根离子与碘离子的反应;
C.FeSO4可将Cr2O72-还原为Cr3+;
D.Ba(OH)2过量,碳酸氢根离子完全转化成碳酸钡沉淀,钡离子有剩余.
解答 解:A.过量的SO2通入NaOH溶液中:SO2+OH-═HSO3-,故A错误;
B.硝酸铁溶液中滴加足量HI溶液,铁离子和硝酸根离子都参与反应,正确的离子方程式为:Fe3++3NO3-+12H++10I-=Fe2++5I2+3NO↑+6H2O,故B错误;
C.FeSO4可将Cr2O72-还原为Cr3+:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,故C正确;
D.向NaHCO3溶液中加入过量的Ba(OH)2,反应生成氢氧化钠、水和碳酸钡沉淀,反应的离子方程式为:Ba2++HCO3-+OH-=BaCO3↓+H2O,故D错误.
故选C.
点评 本题考查离子方程式的书写,题目难度中等,本题中注意把握物质的性质以及反应的过量问题,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ③⑤⑦ | C. | ③⑥⑦ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度越高,镁与水反应的速率越快 | |
| B. | 镁与水反应的化学方程式为:Mg+2H2O═Mg(OH)2+H2↑ | |
| C. | 氢氧化镁显碱性,且在水中有一定的溶解性 | |
| D. | 氢氧化镁是离子化合物,它的电子式可表示为: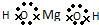 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把钠放入足量稀盐酸中 | |
| B. | 将钠用铝箔包好并刺些小孔,再放入水中 | |
| C. | 把钠放入硫酸铜溶液中 | |
| D. | 把钠放入足量水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA | |
| B. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA | |
| C. | 标准状况下,11.2 L的SO3所含分子数为0.5NA | |
| D. | 室温下,8 g甲烷含有共价键数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol氦气分子中含2NA个氦原子 | |
| B. | 25℃时,l L pH=13的Ba(OH)2 溶液中含有Ba2+的数目为0.1NA | |
| C. | 在标准状况下,22.4L空气中约有NA个气体分子 | |
| D. | 在0℃,101kPa时,22.4L氢气中含有NA个氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、OH-、SO42- | B. | H+、Na+、HCO3- | C. | NH4+、H+、NO3- | D. | K+、H+、MnO4- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com