
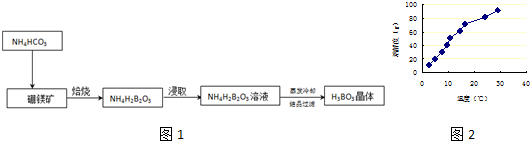
分析 (1)根据反应物的接触面积越大,其反应速率越快,从而缩短反应时间;根据题目信息结合质量守恒可知:硼镁矿焙烧过程中只生成两种物质为NH4H2BO3和MgCO3,根据质量守恒配平;
(2)硼酸溶解度如下所示,从NH4H2BO3溶液获得硼酸晶体蒸发浓缩、冷去结晶、过滤、洗涤、干燥获得硼酸晶体,由溶解度曲线可知,硼酸溶解度随着温度升高增大较快,所以用冷水洗涤能减少硼酸溶解损失;
为了防止洗涤过程中洗涤过程中硼酸晶体的损失,需要用冷水洗涤;
(3)①可通过冰水浴或冷水冲洗来迅速冷却锥形瓶中溶液;
②滴定实验中加入甘油的目的生成稳定配合物强化酸性,酸性增强便于滴定终点的判定,确保测定的准确性;
③根据题目信息:每1.00mlNaOH滴定液相当于30.92mg的H3BO3计算出样品中H3BO3的质量,然后求出质量分数.
解答 解:(1)将固体粉碎,扩大接触面积,使反应更充分,从而增大反应速率;硼镁矿焙烧过程中只生成两种物质为NH4H2BO3和MgCO3,方程式为:Mg2B2O5•H2O+2NH4HCO3=2NH4H2BO3+2MgCO3;
故答案为:扩大接触面积,加快反应速率;Mg2B2O5•H2O+2NH4HCO3=2NH4H2BO3+2MgCO3;
(2)硼酸溶解度如下所示,从NH4H2BO3溶液获得硼酸晶体蒸发浓缩、冷去结晶、过滤、洗涤、干燥获得硼酸晶体,由溶解度曲线可知,为了防止洗涤过程中洗涤过程中硼酸晶体的损失,需要用冷水洗涤,理由是硼酸溶解度随着温度升高增大较快,用冷水洗涤能减少硼酸溶解损失;
故答案为:冷水;硼酸溶解度随着温度升高增大较快,用冷水洗涤能减少硼酸溶解损失;
为了防止洗涤过程中洗涤过程中硼酸晶体的损失,需要用冷水洗涤;理由是硼酸溶解度随着温度升高增大较快,用冷水洗涤能减少硼酸溶解损失;
(3)①迅速冷却锥形瓶中溶液的方法是冰水浴或冷水冲洗;
故答案为:冰水浴或冷水冲洗;
②加入甘油的目的生成稳定配合物强化酸性,酸性增强便于滴定终点的判定,确保测定的准确性;
故答案为:H3BO3酸性太弱,用甘油转化为强酸,便于滴定终点的判定,确保测定的准确性;
③每1.00mlNaOH滴定液相当于30.92mg的H3BO3,用NaOH标准溶液滴定至15.80ml时,溶液恰好显粉红色且半分钟不褪色,则相当于30.92mg×15.8=488.536mg=0.488536gH3BO3,所以测该样品中H3BO3的质量分数为$\frac{0.488536g}{0.5000g}$×100%=97.71%;
故答案为:97.71%.
点评 本题考查了物质制备的流程分析判断,物质性质和实验过程判断,滴定实验的操作过程和计算应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | S=$\frac{100w}{1-w}$ | B. | w=$\frac{4c}{d}$% | ||
| C. | S=$\frac{4000c}{1000d-40c}$ | D. | C=$\frac{m}{40V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,烧杯内盛有浓硝酸,在烧杯中放人用铜线相连的铁、铅两个电极,甲、乙两同学在确定电池的正、负极时发生了争执,甲认为Fe比Pb活泼,Fe应为负极;乙认为Fe在浓硝酸中钝化,Pb应为负极.
如图所示,烧杯内盛有浓硝酸,在烧杯中放人用铜线相连的铁、铅两个电极,甲、乙两同学在确定电池的正、负极时发生了争执,甲认为Fe比Pb活泼,Fe应为负极;乙认为Fe在浓硝酸中钝化,Pb应为负极. 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com