
 实验室可利用该装置来制取氯气,发生反应的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O.
实验室可利用该装置来制取氯气,发生反应的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O.分析 (1)实验目的为制取氯气并用排液法测量氯气的体积,浓盐酸易挥发,从A中出来的氯气中含有氯化氢,应用装置B除去氯化氢,依据氯气在饱和食盐水中溶解度较小选择C中盛放液体;
(2)①在实验室要测定部分变质的过氧化钠的纯度,需要测定氧气体积进行计算;
②过氧化钠和水反应生成氢氧化钠和氧气;
③依据化学方程式计算反应的过氧化钠质量与生成氧气的体积计算样品中的过氧化钠的纯度.
解答 解:(1)实验目的为制取氯气并用排液法测量氯气的体积,浓盐酸易挥发,从A中出来的氯气中含有氯化氢,应用装置B盛有饱和食盐水的洗气瓶除去氯化氢,氯气在饱和食盐水中溶解度较小,所以C中盛放液体为饱和食盐水,
故答案为:除去氯气中的氯化氢;饱和食盐水;
(2)①实验室要测定部分变质的过氧化钠的纯度,需要测定氧气体积,氧气中的杂质气体主要是水蒸气,所以利用装置测定,可以直接进行排水量气方法进行测定,不需要装置B除杂;
故答案为:B;
②烧瓶中发生的反应是过氧化钠滴入水发生的反应,反应的化学方程式为2Na2O2+2H2O═4NaOH+O2↑,故答案为:2Na2O2+2H2O═4NaOH+O2↑;
③取用样品的质量为2.5g,收集到气体的体积为280mL(标准状况)物质的量=$\frac{0.280L}{22.4L/mol}$=0.0125mol,结合化学方程式计算2Na2O2+2H2O═4NaOH+O2↑;
得到反应的过氧化钠物质的量为0.025mol;过氧化钠的质量分数=$\frac{0.025mol×78g/mol}{2.5g}$×100%=78%;
故答案为:78%.
点评 本题考查了实验室制备氯气的方法设计和物质纯度有关计算,明确物质的性质及发生的反应是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 在恒容密闭容器中存在下列平衡:C(s)+H2O(g)?CO(g)+H2(g)的平衡物质的量浓度与温度 T的关系如图所示.下列说法错误的是( )
在恒容密闭容器中存在下列平衡:C(s)+H2O(g)?CO(g)+H2(g)的平衡物质的量浓度与温度 T的关系如图所示.下列说法错误的是( )| A. | 该反应的△H>0 | |
| B. | 若T1、T2 时的平衡常数分别为K1、K2,则K1=K2 | |
| C. | 通过加热可以使B 点变到C 点 | |
| D. | 在T2时若反应进行到状态D,则一定有υ(正)<υ(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,A既能与强酸又能与强碱反应,且都能产生气体,则A的化学式为(NH4)2S或NH4HS.
,A既能与强酸又能与强碱反应,且都能产生气体,则A的化学式为(NH4)2S或NH4HS.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法确定NaHA溶液的酸碱性 | |
| B. | NaHA溶液中:c(H+)=c(A2-)+c(OH-) | |
| C. | 若0.1mol/L NaHA溶液的pH=2,则0.1mol/L H2A溶液中c(H+)=0.11mol/L | |
| D. | 常温下1mol/L NaHA溶液与1mol/L NaOH溶液等体积混合所得溶液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在使石蕊试液变红的溶液中:Na+、NH4+、NO3-、AlO2- | |
| B. | 在含有较多Al3+的溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 室温下,在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液中:K+、I-、Cl-、HS- | |
| D. | 在无色溶液中:SO42-、Cl-、NH4+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴化碘与Br2、I2具有相似的化学性质 | |
| B. | 在许多反应中,IBr是一种强氧化剂 | |
| C. | 在溴化碘与水反应中,IBr既是氧化剂,又是还原剂 | |
| D. | 溴化碘与氢氧化钠溶液反应时可生成两种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
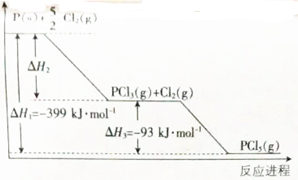
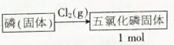

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
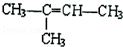 的名称是2-甲基-2-丁烯
的名称是2-甲基-2-丁烯 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com