
| A. | H2 | B. | CO | C. | NH3 | D. | NaCl |
科目:高中化学 来源: 题型:解答题
 (取代反应)
(取代反应)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
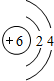 ,C、D、E中原子半径最大的为Na.
,C、D、E中原子半径最大的为Na.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
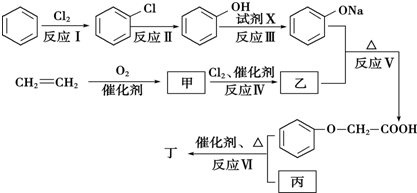
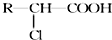
 .
.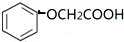 )有多种属于酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上的一硝基取代物只有两种同分异构体的结构简式有
)有多种属于酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上的一硝基取代物只有两种同分异构体的结构简式有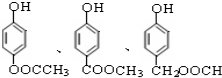 (其中两种)(任写两种即可).
(其中两种)(任写两种即可).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .甲烷的比例模型: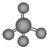 | B. | .氯离子的结构示意图: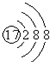 | ||
| C. | CO2分子的电子式: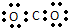 | D. | .中子数为18的硫原子:${\;}_{16}^{34}$S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
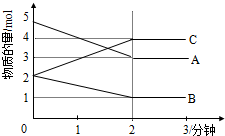 某反应在体积为5L的恒容密闭容器中进行,在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色).
某反应在体积为5L的恒容密闭容器中进行,在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
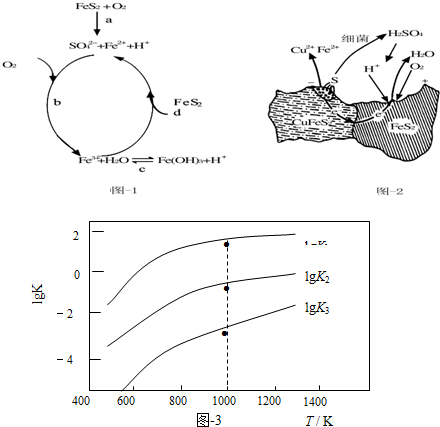
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
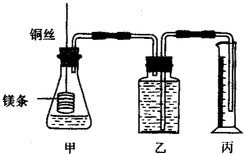 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图,该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图,该实验的主要操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.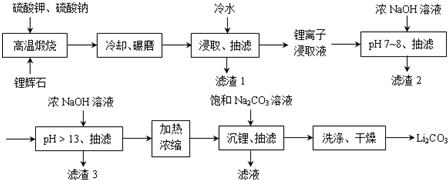
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
| 温度 溶解度 | 10℃ | 20℃ | 50℃ | 80℃ |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com