
| A. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 | |
| B. | 配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 | |
| C. | 用加热的方法可以除去KCl溶液中的Fe3+ | |
| D. | 锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 |
分析 A.氯化氢易挥发,氯化铝溶液加热、蒸干、灼烧,最终得到的是氧化铝;
B.应该溶于稀硫酸,否则引进了杂质氯离子;
C.溶液中存在水解平衡,不能完全除去铁离子;
D.沉淀可以向着更难溶的方向进行,碳酸钙是能溶于盐酸的.
解答 解:A.将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,由于HCl易挥发,则加热氯化铝溶液最终得到的是氧化铝,而加热硫酸铝溶液最终得到的是硫酸铝,所得固体成分不同,故A错误;
B.配制FeSO4溶液时,应该将FeSO4固体溶于稀硫酸中,然后稀释至所需浓度,不能用稀盐酸溶解,故B错误;
C.存在水解平衡,不能完全除去,可加入过量KOH,过滤后再加入盐酸,故C错误;
D.锅炉中沉积的CaSO4用Na2CO3溶液浸泡后,会生成碳酸钙和硫酸钠,碳酸钙可以用稀盐酸溶解去除,故D正确;
故选D.
点评 本题考查较为综合,涉及盐类的水解、难溶物溶解平衡等知识,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液呈酸性,可用氯化铁溶液蚀刻铜电路板 | |
| B. | 铝的金属性比钒强,可用铝与五氧化二钒反应制取金属钒 | |
| C. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 | |
| D. | 二氧化硫具有漂白性,能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液中滴加氢氧化钠溶液 | B. | 硫酸铁溶液中滴加硫氰化钾溶液 | ||
| C. | 氯化亚铁溶液中滴加氯水 | D. | 氯化铁溶液中加入还原铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
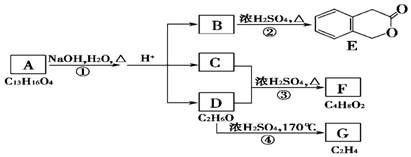
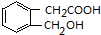
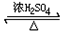
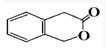 +H2O(有机物须用结构简式表示)
+H2O(有机物须用结构简式表示)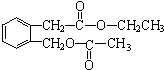 ;反应④的反应类型是消去反应.
;反应④的反应类型是消去反应. .
.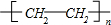 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、SO42-、OH- | B. | Na+、H+、Cl-、SO42- | ||
| C. | Na+、Ca2+、CO32-、NO3- | D. | Ba2+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 |
| A | 加热放在坩埚中的小钠块 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着 |
| C | 在含有酚酞的水中加入一小块钠 | 钠浮在水面上,四处游动,发出嘶嘶响声,溶液变红 |
| D | 在空气中久置的铝条放入NaOH溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com