
| A. | △H>0、△S<0 | B. | △H>0、△S>0 | C. | △H<0、△S<0 | D. | △H<0、△S>0 |
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42- | |
| B. | pH=2的酸溶液1mL,加水稀释至100mL后,溶液pH=4 | |
| C. | 过量SO2通入Ba(NO3)2溶液中,正确的离子方程式为3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+ | |
| D. | 用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液,所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 项目 | 空气污染指数 | 空气质量级别 | 空气质量 |
| 可吸入颗粒物 | 65 | Ⅱ | 良 |
| 二氧化硫 | 6 | ||
| 二氧化氮 | 20 |
| A. | 用氢气作燃料 | B. | 露天焚烧垃圾 | ||
| C. | 大量排放汽车尾气 | D. | 用煤作燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Na+、SO42-、CO32- | B. | K+、Fe2+、SO42-、MnO4- | ||
| C. | Ba2+、K+、Al3+、Cl- | D. | Na+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
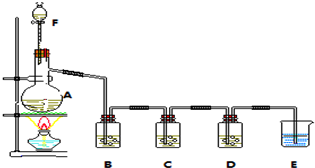
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
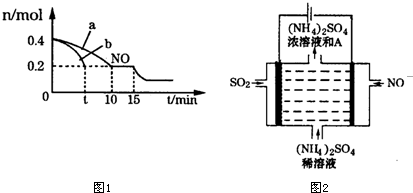
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com