
【题目】将1molCO和1molH2O充入容器中,在催化剂存在下发生反应H2O (g)+CO(g)H2 (g)+CO2(g)达到平衡时,发现有50%的CO转化为CO2 . 在其他条件不变的情况下,若将1molCO和3molH2O充入反应器中,则反应达平衡后,求:
(1)达平衡后CO的转化率
(2)混合气体中CO2体积分数.
【答案】
(1)解:达到平衡时,发现有50%的CO转化为CO2,则转化的CO为1mol×50%=0.5mol,则
H2O (g)+ | CO(g) | H2 (g)+ | CO2(g) | ||
开始 | 1 | 1 | 0 | 0 | |
转化 | 0.5 | 0.5 | 0.5 | 0.5 | |
平衡 | 0.5 | 0.5 | 0.5 | 0.5 |
则K= ![]() =1,
=1,
在其他条件不变的情况下,若将1molCO和3molH2O充入反应器中,设转化的CO为x,则
H2O (g)+ | CO(g) | H2 (g)+ | CO2(g) | ||
开始 | 3 | 1 | 0 | 0 | |
转化 | x | x | x | x | |
平衡 | 3﹣x | 1﹣x | x | x |
则K= 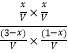 =1,解得x=0.75mol
=1,解得x=0.75mol
达平衡后CO的转化率为 ![]() ×100%=75%,
×100%=75%,
答:CO的转化率为75%;
(2)解:混合气体中CO2体积分数为 ![]() ×100%=18.75%,答:CO2体积分数为18.75%
×100%=18.75%,答:CO2体积分数为18.75%
【解析】达到平衡时,发现有50%的CO转化为CO2 , 则转化的CO为1mol×50%=0.5mol,则
H2O (g)+ | CO(g) | H2 (g)+ | CO2(g) | ||
开始 | 1 | 1 | 0 | 0 | |
转化 | 0.5 | 0.5 | 0.5 | 0.5 | |
平衡 | 0.5 | 0.5 | 0.5 | 0.5 |
则K= ![]() =1,
=1,
在其他条件不变的情况下,若将1molCO和3molH2O充入反应器中,设转化的CO为x,则
H2O (g)+ | CO(g) | H2 (g)+ | CO2(g) | ||
开始 | 3 | 1 | 0 | 0 | |
转化 | x | x | x | x | |
平衡 | 1﹣x | x | x |
则K= 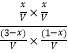 =1,解得x=0.75mol,以此来解答.
=1,解得x=0.75mol,以此来解答.
【考点精析】掌握化学平衡常数的含义和化学平衡的计算是解答本题的根本,需要知道指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度不变的状态;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙和X是四种中学化学中常见的物质,其转化关系如图,则甲和X不可能是( )
A.甲为C,X是O2
B.甲为SO2 , X是NaOH溶液
C.甲为Cl2 , X为Fe
D.甲为Al,X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如图K8﹣4所示.将D溶液滴入沸水中可得到以F为分散质的红褐色胶体.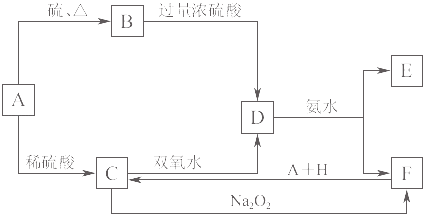
请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围: .
(2)A,B,H的化学式:A、B、H .
(3)①H2O2分子的电子式为 .
②写出C的酸性溶液与双氧水反应的离子方程式: .
(4)写出鉴定E中阳离子的实验方法和现象: .
(5)在C溶液中加入与C等物质的量的Na2O2 , 恰好使C转化为F,写出该反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)CH3﹣CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
化学键 | C﹣H | C=C | C﹣C | H﹣H |
键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
试计算该反应的反应热△H= .
(2)白磷与氧可发生如下反应:P4(S)+5O2(g)=P4O10(S) . 已知断裂下列化学键需要吸收的能量分别为如下
化学键 | P﹣P | P﹣O | P=O | O﹣O | O=O |
键能(kJ/mol) | a | b | c | d | e |
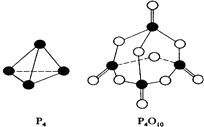
根据图示的分子结构和有关数据估算该反应的△H=;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气. 已知:①N2(g)+2O2(g)=N2O4(1)△H1=﹣195.0kJmol﹣1
②N2H4(1)+O2(g)=N2(g)+2H2O(g)△H2=﹣534.2kJmol﹣1
写出肼和N2O4反应的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mLFeBr2溶液中通入标况下氯气3.36L,氯气全部被还原,测得溶液c(Br-)=c(Cl-),原溶液中FeBr2溶液的浓度(mol·L-1)
A. 1 B. 1.5 C. 2 D. 2.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在科研与生活中有重要应用.某兴趣小组用0.50molL﹣1KI、0.2%淀粉溶液、0.20molL﹣1K2S2O8、0.10molL﹣1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知: S2O82﹣+2I﹣═2SO42﹣+I2(慢) I2+2S2O32﹣═2I﹣+S4O62﹣(快)
(1)向KI,Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的耗尽后,溶液颜色将由无色变成为蓝色.其中该反应速率快慢的是由(填“第一个”或“第二个”)反应决定的.为确保能观察到蓝色,S2O32﹣与S2O82﹣初始的物质的量需满足的关系为:n(S2O32﹣):n(S2O82﹣) .
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号 | 体积/mL溶液 | ||||
K2S2O8溶液 | H2O | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | V1 | V3 | 4.0 | 2.0 |
③ | 8.0 | V2 | V4 | V5 | 2.0 |
表中V3、V4和V5取实验设计的体积数值,目的是 , 表中的V2= , 理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去).
已知:2NO+CaO2═Ca(NO2)2;2NO2+CaO2═Ca(NO3)2 .
请回答下列问题:
a.向装置中通入N2 b.向三颈烧瓶中滴加稀硝酸 c.点燃酒精灯 d.熄灭酒精灯 e.停止通入氮气 f.关闭分液漏斗旋塞
(1)上述操作的正确排序为、c、、f、、 .
(2)B中盛放的试剂是 , 作用是除去(填化学式).
(3)装置E中,酸性K2Cr2O7溶液的作用:可将剩余的NO氧化成NO ![]() ,溶液由橙色变为绿色(Cr3+),反应的离子方程式是 .
,溶液由橙色变为绿色(Cr3+),反应的离子方程式是 .
(4)已知Ca(NO2)2溶液需保持弱碱性,因为其遇酸会发生反应,产生NO气体.设计实验证明D中有亚硝酸钙生成 .
(5)整个过程持续通入氮气的作用 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像均为实验过程中产生沉淀的物质的量(Y)与加入试剂的量(X)之间的关系图,则其中正确的是( )


A B C D
A. 向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B. 向NaAlO2溶液中逐滴滴加稀盐酸至过量且边滴边振荡
C. 向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量
D. 向等物质的量浓度的NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入CO2至过量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com