
| A. | F2、K、Cl2 | B. | Cl2、Al、H2 | C. | NO2、Na、Br2 | D. | O2、SO2、H2O |
分析 由物质所含元素的化合价判断性质,若物质所含元素化合价处于中间价态,则物质既有氧化性又有还原性,处于最低价只有还原性,处于最高价只有氧化性,以此来解答.
解答 解:A.F2只有氧化性,F2化合价只能降低,K化合价只能升高,所以K只有还原性,氯气中Cl元素的化合价为中间价,氯气既有氧化性又有还原性,故A选;
B.Cl2既有氧化性又有还原性,金属铝和氢气只有还原性,故B不选;
C.二氧化氮和水的反应说明二氧化氮既有氧化性又有还原性,金属钠只有还原性,溴单质既有氧化性又有还原性,故C不选;
D.氧气中O元素的化合价只能降低,只具有氧化性,二氧化硫中硫元素居于中间价,既有氧化性又有还原性,由水中H、O元素的化合价可知,水既有氧化性又有还原性,故D不选.
故选A.
点评 本题考查氧化还原反应,为高频考点,把握化合价与微粒性质的关系为解答的关键,从化合价的变化角度分析氧化还原反应问题,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 青蒿素的一个分子中的含有42个原子 | |
| B. | 青蒿素中碳元素的质量分数约为63.8% | |
| C. | 青蒿素的相对分子质量为282 | |
| D. | 0.1mol青蒿素的质量为28.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | ②和③ | C. | ③和④ | D. | ①和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
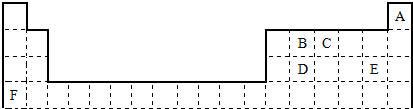
 .比较E、F的两种简单离子的半径大小:E-大于(填大于或小于)F+
.比较E、F的两种简单离子的半径大小:E-大于(填大于或小于)F+查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 使用药品 | 现象 |
| Ⅰ | Na2O2、H2O | ①试管壁发热 ②有无色无味气体产生 |
| Ⅱ | Na2O2、浓盐酸 | ①试管壁发热 ②有刺激性气味的气体产生 ③反应后所得溶液呈浅黄绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液 | B. | 0.5mol•L-1盐酸 | C. | 0.5mol•L-1H2SO4 | D. | 自来水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在实验室里可用如图所示装置来制取氯酸钠、次氯酸钠和探究氯水的性质. 如图中:
在实验室里可用如图所示装置来制取氯酸钠、次氯酸钠和探究氯水的性质. 如图中:| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | HClO有强氧化性,体现漂白作用是其褪色 |
| 然后溶液从无色逐渐变为溶液颜色变为浅绿色色 | 溶液中溶解了大量的氯气,体现浅绿色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com