
【题目】镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点。如图为镁——次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
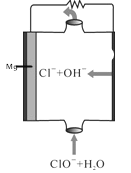
A. 该燃料电池中镁为负极,发生氧化反应
B. 正极反应式为ClO―+H2O+2e―= Cl―+2OH―
C. 放电过程中OH―移向正极移动.
D. 电池总反应式为Mg+ClO―+H2O=Mg(OH)2↓+Cl―
【答案】C
【解析】
该燃料电池中,镁易失电子作负极、次氯酸根离子得电子发生还原反应,负极电极反应式为Mg-2e-=Mg2+,正极电极反应式为:ClO-+H2O+2e-=Cl-+2OH-,放电时,电解质溶液中阴离子向负极移动。
A.镁失电子发生氧化反应而作负极,所以A选项是正确的;
B.正极上双氧水得电子发生还原反应,电极反应式为ClO-+H2O+2e-= Cl-+2OH-,所以B选项是正确的;
C.放电过程中氢氧根离子向负极移动,所以C选项是错误的;
D.镁在负极上失电子生成镁离子,次氯酸根离子在正极上得电子和水生成氯离子和氢氧根离子,所以电池反应式为Mg+ ClO-+H2O=Mg(OH)2↓+ Cl-,所以D选项是正确的。
故答案选C。


科目:高中化学 来源: 题型:
【题目】铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如下:

(1)“酸溶”时加快反应速率的方法有___________________(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2 +14Fe3+ +8H2O=15Fe2++2SO42-+16H+,则另一个反应的离子方程式为:___________;
②FeS2还原后,检验Fe3+是否反应完全的方法是___________。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有___杂质;
②写出加入NH4HCO3生成“沉淀”的化学方程式:___________________;
③所得FeCO3需充分洗涤,检验沉淀已洗涤干净的方法是_________________。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为_________(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧34.8g的FeCO3,得到Fe2O3和FeO的混合物23.76g。则Fe2O3的质量为______ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几种反应类型:①消去②加聚③水解④加成⑤还原⑥氧化,用CH3CH2CH2Cl制取1,2—丙二醇,按正确的合成路线依次发生的反应所属类型应是 ( )
A. ①④③B. ③④①C. ③①④D. ①⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期元素,B是非金属性最强的元素,A分别与 B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三种分子中含相同数目的质子,乙常温下为液态化合物, C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图所示:

(1)写出B+乙 → 甲+C的化学反应方程式___________________________________________。
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是_______。(填写序号)
①A ②B ③C ④D
(3)依据下列条件可以进一步确定上述第四种元素:① 甲与丙以及乙与丙均能够发生反应,
② 甲、丙都是无色、有刺激性气味的物质。据此,请回答下列问题:写出上述第四种元素在周期表中第_________ 周期第_________ 族;写出 C+丙 → 乙+丁 的化学反应方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属电化学腐蚀的说法正确的是( )
A. 铜既可以发生析氢腐蚀也可以发生吸氧腐蚀
B. 牺牲阳极的阴极保护法中被保护的金属应做负极
C. 外加电流阴极保护法中被保护的金属应与电源的负极相连
D. 析氢腐蚀比吸氧腐蚀普遍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图甲可以判断出反应A(g) + B(g)![]() 2C(g) 的△H<0,T2>T1
2C(g) 的△H<0,T2>T1
B. 图乙表示压强对可逆反应2A(g) + 2B(g)![]() 3C(g) + D(s)的影响,乙的压强比甲的压强大
3C(g) + D(s)的影响,乙的压强比甲的压强大
C. 据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH≈4
D. 图丁表示25℃时,用0.1 mol·L—1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入盐酸体积的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于![]() Lv 的叙述错误的是
Lv 的叙述错误的是
A. 原子序数 116B. 中子数 177
C. 核外电子数 116D. 核电荷数 293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】达康书记又追问环保局长:那么垃圾处理中,能随便焚烧吗?焚烧垃圾会降低GDP的。请问,在焚烧垃极过程中发生了
A. 不能,吸热非氧化还原反应 B. 能,吸热的氧化还原反应
C. 能,放热的非氧化还原反应 D. 不能,放热的氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在试管Ⅰ和Ⅱ中分别加入3mL稀盐酸(均足量),再将装有0.3gNaHCO3和0.3gNa2CO3粉末的小气球分别套在Ⅰ和Ⅱ的管口。各将气球内的NaHCO3、Na2CO3同时倒入试管中,回答:
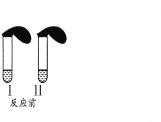
①I试管发生的离子方程式: _______________________;
②两支试管中充分反应后生成的气体总量Ⅰ_____Ⅱ,反应结束时消耗盐酸的物质的量Ⅰ_____Ⅱ(填“>”“=”或“<”)。
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度升高。由此他得出:不管其状态如何,NaHCO3和盐酸反应为吸热反应,而Na2CO3和盐酸反应为放热反应。乙同学认为甲同学的判断太武断,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
1 | 50mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
2 | 50mL水 | 3.2gNa2CO3固体 | 20℃ | 24.3℃ |
3 | 35mL稀盐酸 | 含2.5gNaHCO3的饱和溶液15mL | 20℃ | 18.8℃ |
4 | 35mL稀盐酸 | 含3.2gNa2CO3饱和溶液15mL[来 | 20℃ | 24.2℃ |
5 | 50mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | T℃ |
6 | 50mL稀盐酸 | 3.2gNa2CO3固体 | 20℃ | 25.1℃ |
通过上述实验可得出:
①Na2CO3的饱和溶液和盐酸的反应是___________(吸热或放热)反应;
②NaHCO3的饱和溶液和盐酸的反应是__________(吸热或放热)反应;
③表中⑤号试验混合后温度T℃可能是(填编号)_________________________。
A.18.5℃ B. 24.2℃ C.16.2℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com