
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
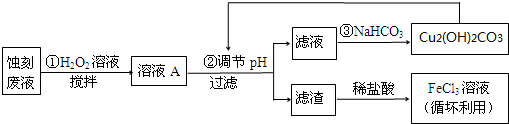
分析 (1)加入氢氧化钙溶液生成氢氧化铁沉淀,根据氢氧化铁的Ksp表达式Ksp=[Fe3+][[OH-]3],可计算pH为5时铁离子浓度;
(2)FeCl3-HCl溶液蚀刻铜板后的废液,发生2Fe3++Cu=2Fe2++Cu2+,得到氯化铜、氯化亚铁和氯化铁的混合溶液,向废液中滴入过氧化氢将亚铁离子氧化成极易除去的铁离子,然后过滤得沉淀氢氧化铁和氯化铜溶液,将沉淀溶解于盐酸得到氯化铁,向滤液中加入碳酸氢钠得到碱式碳酸铜,以此解答该题.
解答 解:(1)加入氢氧化钙溶液,发生Fe3++3OH-=Fe(OH)3↓,根据氢氧化铁的Ksp表达式:Ksp=[Fe3+][[OH-]3],溶液的pH为5即[H+]=10-5mol/L,所以金属铁离子浓度为4.0×10-11 mol•L-1,
故答案为:Fe3++3OH-=Fe(OH)3↓;4.0×10-11;
(2)①氯化铁与铜反应生成氯化亚铁和氯化铜,反应的离子方程式:2Fe3++Cu=2Fe2++Cu2+,铁离子可能过量,故答案为:Fe3+、Fe2+和Cu2+;
②氯化铁是强酸弱碱盐水解呈酸性,所以加盐酸防止弱离子铁离子的水解,水解的方程式为:Fe3++3H2O?Fe(OH)3+3H+,向其中加盐酸促使平衡逆向移动,
故答案为:抑制氯化铁水解;
③加入氧化剂把亚铁离子氧化为铁离子但不能引入新的杂质,氧化剂选择过氧化氢氧化亚铁离子的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:因为将Fe2+氧化成Fe3+,方便后续沉淀时除去;
④调节溶液的pH目的是使铁离子全部沉淀,铜离子不沉淀,依据图表数据分析可知pH应为:3.2~4.7,故答案为:[3.2,4.7)或3.2≤pH<4.7;
⑤用碱式碳酸铜来调节溶液的PH,强制弱,所以离子反应方程式为:4H++Cu2(OH)2CO3 =3H2O+2 Cu2++CO2↑,
故答案为:4H++Cu2(OH)2CO3 =3H2O+2 Cu2++CO2↑.
点评 本题考查了物质制备实验设计、物质分离的实验基本操作,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握物质性质的理解,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98 | |
| B. | 通电时,溶液中的溶质分子分别向两极移动,胶体中的分散质粒子向某一极移动 | |
| C. | 丁达尔效应可用于区别溶液和胶体,云、雾均能产生丁达尔效应 | |
| D. | 将98gH2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 112 mL | B. | 224 mL | C. | 336 mL | D. | 448 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )| A | B | C | D | |
| X | CO2 | HCl | NaOH | AlCl3 |
| Y | Ca(OH)2 | Na[Al(OH)4] | AlCl3 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1H2C2O4溶液 | 水 | 1mol•L-1MnSO4溶液 | 反应温度/℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | V1 mL | V2 mL | 1mL | 0 | 20 | 320 |
| Ⅲ | V3 mL | V4 mL | V5mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | 只有② | C. | 只有③ | D. | 只有②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸体积(mL) | 30.0 | 30.0 | 30.0 | 30.0 |
| 样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
| CO2的体积(mL) | 672 | 840 | 896 | 672 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com