
 �״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״����ڹ̶������н��У���2H2��g��+CO��g��?CH3OH��g��
�״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״����ڹ̶������н��У���2H2��g��+CO��g��?CH3OH��g��| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
���� ��1�������ݻ�ѧ����ʽ��ƽ�ⳣ��������д������ƽ�ⳣ�����¶ȱ仯�жϷ�Ӧ�����仯��
��300�淴Ӧ��ƽ�ⳣ��K=0.270������Ũ���̺�ƽ�ⳣ���Ƚ�ƽ����Ӧ���еķ���
��Ҫ���CO��ת���ʣ�һ��ʹƽ�������ƶ����ɣ�������CO��Ũ��ƽ����Ȼ�����ƶ�����CO��ת���ʼ�С���ݴ˷�����
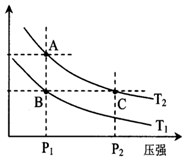
��2������ѹǿԽ��Ӧ����Խ���жϣ���ѧƽ�ⳣ�������¶��йأ���״̬B��״̬A���ɲ������µķ�����
��3����2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��g�� K1=$\frac{{c}^{4}��{H}_{2}O��{c}^{2}��C{O}_{2}��}{{c}^{3}��C{H}_{3}OH��{c}^{3}��{O}_{2}��}$
��2CO��g��+O2��g���T2CO2��g�� K2=$\frac{{c}^{2}��C{O}_{2}��}{{c}^{2}��CO��c��{O}_{2}��}$
��H2O��g���TH2O��l�� K3=$\frac{1}{c��{H}_{2}O��}$
��CH3OH��l��+O2��g���TCO��g��+2H2O��l�� K4=$\frac{c��CO��{c}^{2}��{H}_{2}O��}{c��C{H}_{3}OH��c��{O}_{2}��}$
��� �⣺��1����K=$\frac{c��C{H}_{3}OH��}{c��CO��{c}^{2}��{H}_{2}��}$�ɱ������ݿ�֪�¶����ߣ�Kֵ��С��˵��ƽ�����淴Ӧ�����ƶ����淴ӦΪ���ȷ�Ӧ������Ӧ��Ϊ���ȷ�Ӧ��H��0��
�ʴ�Ϊ��$\frac{c��C{H}_{3}OH��}{c��CO��{c}^{2}��{H}_{2}��}$������
��300�淴Ӧ��ƽ�ⳣ��K=0.270����2mol CO��6mol H2��4molCH3OH����2L���ܱ������У�Qc=$\frac{\frac{4mol}{2L}}{\frac{2mol}{2L}����\frac{6mol}{2L}��^{2}}$=$\frac{2}{9}$=0.22��K=0.270����Ӧ������У�
�ʴ�Ϊ������
��a������ƽ�������ƶ�����CO��ת���ʼ�С���ʴ���
b���������ƽ�ⲻ�ƶ�����CO��ת���ʲ��䣬�ʴ���
c������CO��Ũ�ȣ�ƽ����Ȼ�����ƶ�����CO��ת���ʼ�С���ʴ���
d������H2��ѹ��ƽ�������ƶ���CO��ת������ߣ�����ȷ��
e��������������ѹ��ƽ�ⲻ�ƶ�����CO��ת���ʲ��䣬�ʴ���
f��������״���ƽ�������ƶ���CO��ת������ߣ�����ȷ��
��ѡ��d f��
��2����ΪѹǿԽ��Ӧ����Խ������A��C����ķ�Ӧ����A��C����ѧƽ�ⳣ�������¶��йأ�����A��C����Ļ�ѧƽ�ⳣ��A=C����״̬B��״̬A���ɲ������µķ������ʴ�Ϊ������=�����£�
��3����2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��g�� K1=$\frac{{c}^{4}��{H}_{2}O��{c}^{2}��C{O}_{2}��}{{c}^{3}��C{H}_{3}OH��{c}^{3}��{O}_{2}��}$
��2CO��g��+O2��g���T2CO2��g�� K2=$\frac{{c}^{2}��C{O}_{2}��}{{c}^{2}��CO��c��{O}_{2}��}$
��H2O��g���TH2O��l�� K3=$\frac{1}{c��{H}_{2}O��}$
��CH3OH��l��+O2��g���TCO��g��+2H2O��l��
K4=$\frac{c��CO��{c}^{2}��{H}_{2}O��}{c��C{H}_{3}OH��c��{O}_{2}��}$=$\frac{{{K}_{1}}^{\frac{1}{2}}{{K}_{3}}^{2}}{{K}_{2}\frac{1}{2}}$��
�ʴ�Ϊ��$\frac{{{K}_{1}}^{\frac{1}{2}}{{K}_{3}}^{2}}{{K}_{2}\frac{1}{2}}$��
���� ���⿼����ƽ��״̬���жϣ�ƽ�ⳣ������ʽ�ͼ��㣬ƽ���ƶ�ԭ������Ӧ�õȣ����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʹ�õζ���ʱ���ζ��ܱ����ô�װҺ��ϴ2��3�� | |
| B�� | ��ʽ�ζ��ܲ���ʢװ��Һ����ʽ�ζ��ܲ���ʢװ��Һ | |
| C�� | ʢ��ȷ��ȡ����Һ����ƿӦԤ���ô���Һ��ϴ | |
| D�� | �ζ�����Ӧ�ظ�2��3�Σ�������ζ���ȥ����Һ�����ƽ��ֵ�����������Һ��Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �˹�������ü�ӵ绯ѧ������ȥ��л�����е�����[CO��NH2��2]��ԭ����ͼ�������й�˵����ȷ���ǣ�������
�˹�������ü�ӵ绯ѧ������ȥ��л�����е�����[CO��NH2��2]��ԭ����ͼ�������й�˵����ȷ���ǣ�������| A�� | AΪ��Դ�ĸ��� | |
| B�� | ����������������Һ��pH����ǰ��Ƚ����� | |
| C�� | �������з����ĵ缫��ӦΪ2H++2e-�TH2�� | |
| D�� | ���������ռ�������13.44 L����״���������ȥ������Ϊ18g������������ܽ⣩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | PBr3��NO2 | B�� | CH4��SCl2 | C�� | BF3��SO2 | D�� | H2O��CS2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ԫ�� | B�� | ��Ԫ�� | C�� | ��Ԫ�� | D�� | ��Ԫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.8��10-13 mol•L-1 | B�� | 7.3��10-13 mol•L-1 | ||
| C�� | 2.3 mol•L-1 | D�� | 3.7 mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Al��OH��3 | Fe��OH��3 | |
| ��ʼ����ʱ | 3.4 | 1.5 |
| ��ȫ����ʱ | 4.7 | 2.8 |

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com