
| A.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止 |
| B.Ksp越小,难溶电解质在水中的溶解能力一定越弱 |
| C.Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关 |
| D.相同温度下, AgCl在水中的溶解能力与在NaCl溶液中的相同 |
科目:高中化学 来源:不详 题型:单选题
| A.AgCl饱和溶液中c(Ag+)比AgI饱和溶液中c(Ag+)大 |
| B.AgCl饱和溶液中c(Ag+)比Mg(OH)2饱和溶液中c(Mg2+)大 |
| C.将AgCl与AgI的饱和溶液等体积混合,再加入足量浓AgNO3溶液,则发生的反应为:AgCl与AgI沉淀都有,但以AgI沉淀为主。 |
| D.若往AgCl饱和溶液中加入0.1 mol/LKI溶液,有黄色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的C(Mg2+)大 |
| B.25 ℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,C(Mg2+)增大 |
| C.25 ℃时,Mg(OH)2固体在20 mL 0.01 molL-1氨水中的Ksp比在20 mL 0.01molL-1NH4Cl溶液中的Ksp小 |
| D.25 ℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 温度/℃ | 25 | t1 | t2 |
| Kw/ mol2·L-2 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
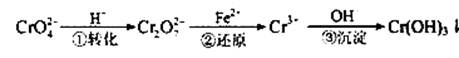
 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大 |
B.AgCl悬浊液中存在平衡:AgCl(s) 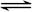 Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 |
| C.为减小洗涤过程中固体的损失,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀 |
| D.硬水中含有较多的Ca2+、Mg2+、HCO3-、SO42-,加热煮沸可以完全除去其中的 Ca2+、Mg2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
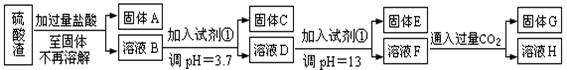
| A.氢氧化钠 | B.氧化铝 | C.氨水 | D.水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.汽油燃烧时将全部的化学能转化为热能 |
| B.饱和石灰水中加入一定量生石灰,所得溶液的pH增大 |
| C.向AgCl悬浊液中加入KI溶液,白色沉淀转化为黄色沉淀,说明溶解度AgCl<AgI |
| D.向AgCl悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
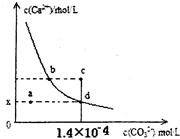
| A.x的数值为2×10-5 |
| B.c点时有CaCO3生成 |
| C.加入蒸馏水可使溶液由d点变成 a点 |
| D.b点与d点对应的溶度积相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com