
| A.AlCl3为离子化合物 | B.SiCl4为共价化合物 |
| C.P 与Cl可形成离子键 | D.K与Mg 形成共价键 |
科目:高中化学 来源:不详 题型:单选题
| A.分子晶体中都存在共价键 |
| B.F2、C12、Br2、I2的熔沸点逐渐升高与分子间作用力有关 |
| C.含有极性键的化合物分子一定不含非极性键 |
| D.只要是离子化合物,其熔点一定比共价化合物的熔点高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
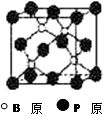
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
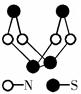
| A.该物质的分子式为SN |
| B.该物质的分子中既有极性键又有非极性键 |
| C.该物质中的N原子最外层都达到8电子稳定结构 |
| D.该物质与化合物S2N2互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两种元素组成的分子中所含化学键一定是极性键 |
| B.金属晶体的熔点一定比分子晶体的高 |
| C.某晶体中含有阳离子,则一定也含有阴离子 |
| D.含有阴离子的化合物一定含有阳离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
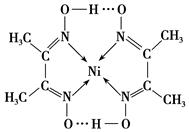
| A.氢键 | B.离子键 | C.共价键 | D.金属键 E.配位键 |
 ②
② 、③
、③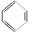 、④ HCHO等,其中碳原子采取sp2杂化的分子有________(填序号);HCHO分子的空间构型为________ 。
、④ HCHO等,其中碳原子采取sp2杂化的分子有________(填序号);HCHO分子的空间构型为________ 。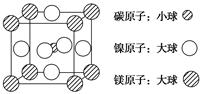
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com