
| n |
| V |
| △c |
| △t |
| n |
| V |
| 1.8mol |
| 2L |
| n |
| V |
| 0.2mol |
| 2L |
| △c |
| △t |
| ||
| 1min |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、在强碱性溶液中:NH4+、Ag+、NO3-、I- |
| B、在pH=12的溶液中:Na+、K+、AlO2-、CO32- |
| C、在c(H+)=0.1 mol?L-1的溶液中:Ca2+、Fe2+、ClO-、Cl- |
| D、在强酸性溶液中:Mg2+、Al3+、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
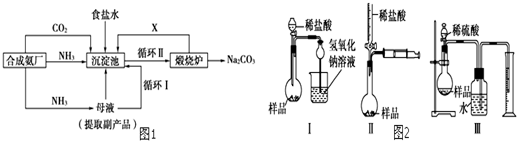
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充分水解 |
| 发酵 |
| 氧化 |
| 氧化 |
| 酯化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热某废塑料得到的产物如表:
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热某废塑料得到的产物如表:| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
| ① |
| ② |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| [B] |
| [OH-] |
| [OH-] |
| [H+] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com