
【题目】关于SO2的叙述中,正确的是( )
A.SO2的摩尔质量是64g
B.1 molSO2中所含分子数约为6.02×1023个
C.1 molSO2的质量是64g/mol
D.常温常压下,1 molSO2的体积为22.4 L
科目:高中化学 来源: 题型:
【题目】下列关于化学观或化学研究方法的叙述中,错误的是( )
A.在化工生产中应遵循“绿色化学”的思想
B.在过渡元素中寻找优良的催化剂
C.在元素周期表的金属和非金属分界线附近寻找半导体材料
D.根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离方法不正确的是 ( )
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用淘洗的方法从沙里淘金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业含铬(Cr)废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀.废水pH与Cr2O72-转化为Cr3+的关系如图1,实验室模拟工业电解法处理含铬废水的装置如图2:
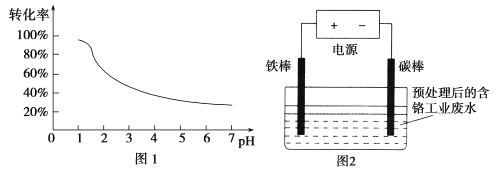
有关数据如下表所示:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cr(OH)3 |
开始沉淀的pH | 1.9 | 7.5 | 4.3 |
完全沉淀的pH | 3.4 | 9.7 | 7.6 |
请根据以上知识回答下列问题:
(1)含铬废水预处理的方法是 。
(2)电解过程中阳极质量减小,阴极有气体产生,写出两极的电极反应式:
阳极 ,阴极 。
(3)写出Cr2O72-转化为Cr3+的离子方程式: 。
(4)每处理1molCr2O72-,外电路中转移 mol电子。
(5)电解过程中解液的pH (填增大、减小或不变)
(6)处理过程中,当废水颜色不再发生明显变化时,切断电源,取出电极。此时,溶液中的阳离子有Fe2+、Fe3+、Cr3+,若想用调节pH的方法得到纯净的Cr(OH)3沉淀,应先向溶液中加入适量的 ,再调节pH= ,过滤后继续调节pH= 8。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 离子化合物中可能存在共价键
B. 金属元素与非金属元素形成的化合物中一定存在离子键
C. 溶于水后形成的溶液能导电的化合物中存在离子键
D. 非金属元素形成的物质中一定存在共价键,可能存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均是短周期元素,其原子序数依次增大,A和B同周期,A和D同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,E是所在周期中原子半径最小的元素。请回答:
(1)D在元素周期表中的位置是 。
(2)C2B的电子式是 ;AB2的结构式是 。
(3)B、C、E的离子半径由大到小的顺序为 (用化学式回答,下同);A、D、E元素最高价氧化物对应水化物的酸性由强到弱为 。
(4)B的气态氢化物与H2S相比沸点高的是 (用化学式回答);原因是 。
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生异味,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀MnO2,当消耗13.50gEB2时,共转移了1mol电子,则反应的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com