
【题目】如图表示的是难溶氢氧化物在不同pH下的溶解度(S),下列说法正确的是( )
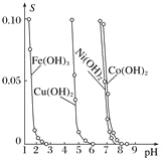
A. pH=3时溶液中铁元素的主要存在形式是Fe3+
B. 若Ni(NO3)2溶液中含有少量的Co2+杂质,可通过调节溶液pH的方法除去
C. 若要分离溶液中的Fe3+和Cu2+,可调节溶液的pH为4
D. 若向含有相同物质的量浓度的Cu2+和Ni2+的溶液中加入烧碱,Ni(OH)2优先沉淀
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】298 K、101kPa时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是( )
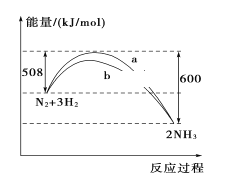
A. 加入催化剂,不能改变该化学反应的反应热
B. b曲线是加入催化剂时的能量变化曲线
C. 该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
D. 在常温、体积一定的条件下,通入1 mol N2和3 mol H2,反应后放出的热量为92 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行相应实验,能达到实验目的的是( )
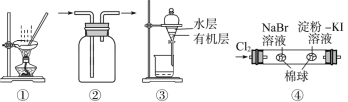
A. 用图①所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体
B. 按装置②所示的气流方向可用于收集H2、NH3等
C. 用图③所示装置,分离CCl4萃取I2水后的有机层和水层
D. 用图④所示装置,可以证明氧化性:Cl2>Br2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和限度的说法中,正确的是( )
A.铁与硝酸反应时,其他条件一定时,硝酸越浓,反应速率越快
B.在金属钠与足量水反应中,增加水的量能加快反应速率
C.在2SO2+O2![]() 2SO3反应中加入18O2,达到平衡后SO2中不可能含有18O2
2SO3反应中加入18O2,达到平衡后SO2中不可能含有18O2
D.无论是吸热还是放热反应,加热都能加快化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究甲烷与氯气的取代反应,装置、现象如下:
现象 |
ⅰ.光照后,产生白雾,混合气体颜色变浅 ⅱ.试管内液面上升至试管的2/3;试管壁和液面上出现少量油状液滴 |

下列说法不正确的是
A. 饱和食盐水可以减少氯气的溶解
B. 油状液滴的主要成分是一氯甲烷
C. 产生白雾以及试管内液面上升证明有氯化氢生成
D. 为了探究反应条件,可用黑色纸套套住装满甲烷和氯气的试管,一段时间后进行观察
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO42-)中回收氧化铁流程如下:

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生的离子反应方程式:___________,指出使用空气的优点是:_________。
(2)已知Fe3+(aq)+3OH-(aq)===Fe(OH)3(s)ΔH=-Q1kJ·mol-1,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=_________。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=___________,c(Mg2+)=___________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时Fe(OH)3沉淀中可能混有的杂质是______ (填化学式,下同),用_______试剂可将其除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
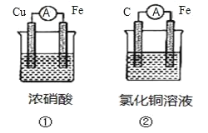
【题目】(1)为了验证 Fe2+与 Cu2+氧化性强弱,下列装置能达到实验目的的是_______(填装置序号), 其正极的电极反应式为_______;若构建该原电池时两个电极的质量相等,当导线中通过 0.4 mol 电子时,两个电极的质量差为_______g。
(2)将 CH4 设计成燃料电池,其利用率更高,装置如图所示(A、B 为多孔碳棒)。

实验测得 OH- 定向移向 A 电极,则_______(填 A 或 B)处电极入口通 CH4,其电极反应式为_______。
(3)金属冶炼和处理常涉及氧化还原反应。由下列物质冶炼相应金属时采用电解法的是_______(填选 项字母)。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极材料分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为Zn+2OH2e===Zn(OH)2,Ag2O+H2O+2e===2Ag+2OH。下列叙述中正确的是( )
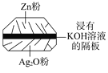
A. 在使用过程中,电解质KOH不断被消耗
B. 使用过程中,电子由Ag2O极经外电路流向Zn极
C. Zn电极发生还原反应,Ag2O电极发生氧化反应
D. Zn是负极,Ag2O是正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
I.将等物质的量的A、B混合放于2 L的密闭容器中,发生反应3A(g)+B(g)![]() xC(g)+2D(g)。经5 min后达到平衡,平衡时测得D的浓度为0.5mol/L,c(A)∶c(B)=3:5,v(C)=0.1 mol/(L·min)。则:
xC(g)+2D(g)。经5 min后达到平衡,平衡时测得D的浓度为0.5mol/L,c(A)∶c(B)=3:5,v(C)=0.1 mol/(L·min)。则:
(1)x=________。
(2)前5 min内B的反应速率v(B)=_________。
(3)平衡时A的转化率为_________。
II.水蒸气通过炙热的碳层发生反应:C(s)+H2O(g)![]() CO(g)+H2(g)△H。
CO(g)+H2(g)△H。
(4)已知:K(300℃)<K(350℃),则该反应是_________热反应。
(5)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(v正)随时间的变化如下图所示,填出对应的编号。

① 缩小容器体积_________;
② 降低温度 ____________;
(6)已知反应①CO(g)+CuO(g)![]() CO2(g)+Cu(s),②H2(g)+CuO(g)
CO2(g)+Cu(s),②H2(g)+CuO(g)![]() Cu(s)+H2O(g),在相同的某温度下的平衡常数分别为K1和K2,该温度下反应CO(g)+H2O(g)
Cu(s)+H2O(g),在相同的某温度下的平衡常数分别为K1和K2,该温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=__________(用K1和K2表示)。
CO2(g)+H2(g)的平衡常数K=__________(用K1和K2表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com