
| A、NaHSO4 |
| B、NaCl |
| C、HCl |
| D、Ba(OH)2 |


科目:高中化学 来源: 题型:
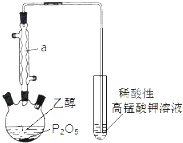 已知用P2O5作催化剂,加热乙醇可制备乙烯,反应温度为80℃~210℃.某研究性小组设计了如下的装置制备并检验产生的乙烯气体(夹持和加热仪器略去).
已知用P2O5作催化剂,加热乙醇可制备乙烯,反应温度为80℃~210℃.某研究性小组设计了如下的装置制备并检验产生的乙烯气体(夹持和加热仪器略去). )
)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10℃20mL3mol?L-1的X溶液 |
| B、20℃30mL2mol?L-1的X溶液 |
| C、20℃10mL4mol?L-1的X溶液 |
| D、10℃10mL2mol?L-1的X溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0mol |
| B、0.5mol |
| C、0.25mol |
| D、0.125mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com