
| A.水和乙醇可以完全互溶 | B.溴化氢比碘化氢稳定 |
| C.干冰易升华 | D.液态氟化氢的化学式有时可以写成(HF)n的形式 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.破损的晶体能够在固态时自动变成规则的多面体 |
| B.缺角的氯化钠晶体在饱和NaCl溶液中慢慢变为完美的立方体块 |
| C.圆形容器中结出的冰是圆形的体现了晶体的自范性 |
| D.由玻璃制成规则的玻璃球体现了晶体的自范性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 a2O2、CaCl2、KOH、NaF中,只含有共价键的物质是_________________,只含有离子键的物质是___________,既含有离子键,又含有共价键的物质是____________。
a2O2、CaCl2、KOH、NaF中,只含有共价键的物质是_________________,只含有离子键的物质是___________,既含有离子键,又含有共价键的物质是____________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
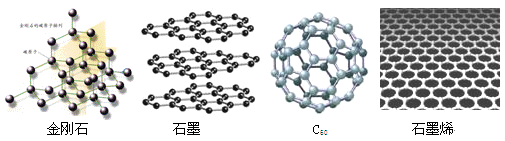
| A.金刚石和石墨烯中碳原子的杂化方式不同 |
| B.金刚石、石墨、C60和石墨烯的关系:互为同素异形体 |
| C.这四种物质完全燃烧后的产物都是CO2 |
| D.石墨与C60的晶体类型相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.乙酸、葡萄糖、淀粉的最简式均为CH2O |
B.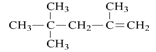 的名称为:2,2,4-三甲基-4-戊烯 的名称为:2,2,4-三甲基-4-戊烯 |
| C.H2O 是一种非常稳定的化合物,这是由于氢键所致 |
| D.熔化时没有化学键断裂的晶体一定是分子晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
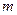 g于体积为V1毫升的定容容器A中;②用滴定管向定容容器A中加入苯,并不断振荡,加苯到定容容器A的刻度线时所加入苯的体积为V2毫升;根据以上操作回答以下问题:
g于体积为V1毫升的定容容器A中;②用滴定管向定容容器A中加入苯,并不断振荡,加苯到定容容器A的刻度线时所加入苯的体积为V2毫升;根据以上操作回答以下问题:
 cm。则利用上述方法测得的阿伏加德罗常数的数学表达式为:
cm。则利用上述方法测得的阿伏加德罗常数的数学表达式为: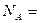 ______________________;
______________________;查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 | ||||
| 920℃ | 97.8℃ | 1291℃ | 190℃ | 2073℃ | -107℃ | -57℃ | 1723℃
查看答案和解析>> 科目:高中化学 来源:不详 题型:填空题 (5分)(1)氯酸钾熔化,粒子间克服的作用力是________;二氧化硅熔化,粒子间克服的作用力是________;碘的升华,粒子间克服的作用力是________。三种晶体的熔点由高到低的顺序是________。 (2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤金刚石,它们的熔点从低到高的顺序为__________(填序号)。 查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |