
分析 (1)盖斯定律的内容为:化学反应的反应热值与反应的始态和终态有关,而与反应进行的途径无关;根据盖斯定律,用第一个热化学方程式减去第二个热化学方程式可得焦炭与水蒸气反应的热化学方程式;
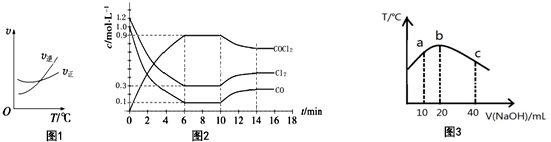
(2)①由图可知,6min时Cl2的平衡浓度为0.3mol/L,变化为1.2mol/L-0.3mol/L=0.9mol/L,根据V=$\frac{△c}{△t}$进行计算;
②Cl2(g)+CO(g)?COCl2(g),反应是气体体积减小的反应,化学反应正逆反应速率相同时反应达到平衡状态,各组分含量保持不变以及衍生的关系分析;
③第8min反应处于平衡状态,在第10分钟时是改变温度使平衡向逆反应方向移动,由④升温平衡向逆反应方向移动,可知正反应为放热反应,升高温度平衡向逆反应方向移动;
④原平衡时n(Cl2):n(CO):n(COCl2)=3:1:9,现在第7 min 加入体系中的三种物质各2 mol,则反应物的浓度增大程度大些,平衡正向移动;
(3)①②HNO2是弱酸,次氯酸电离是吸热反应,酸碱中和反应是放热反应,当恰好完全中和时放出热量最多,据此确定c(NaOH);
③电离吸热,温度越高电离平衡常数越大;
④当c(NaOH)较大时,可能出现:c(Na+)>c(OH-)>c(NO2-)>c(H+).
解答 解:(1)已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8kJ•mol-1,
②C(s)+$\frac{1}{2}$O2(g)═CO(g);△H=-110.5kJ•mol-1,
利用盖斯定律,将②-①可得:C(s)+H2O(g)=CO(g)+H2(g),△H=(-110.5kJ/mol)-(-241.8kJ/mol)=+13l.3 kJ/mol,
所以焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)═CO(g)+H2(g);△H=+13l.3kJ•mol-1,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ•mol-1;
(2)①由图可知,6min时Cl2的平衡浓度为0.3mol/L,变化为1.2mol/L-0.3mol/L=0.9mol/L,则V=$\frac{△c}{△t}$=$\frac{0.9mol/L}{6min}$=0.15 mol•L-1•min -1,
故答案为:0.15 mol•L-1•min -1;
②Cl2(g)+CO(g)?COCl2(g),反应是气体体积减小的反应,
A.体系中Cl2的转化率不变说明反应达到平衡状态,故A正确;
B.反应前后气体物质的量减小,气体质量不变,体系中气体的平均摩尔质量不再改变说明反应达到平衡状态,故B正确;
C.每消耗1mol CO的同时生成1mol COCl2,只能说明反应正向进行,不能说明反应达到平衡状态,故C错误;
D.气体质量和气体体积不变,混合气体密度始终不变,不能说明反应达到平衡状态,故D错误;
故答案为:AB.
③根据图象,第8min反应处于平衡状态,在第10分钟时是改变温度使平衡向逆反应方向移动,由④升温平衡向逆反应方向移动,可知正反应为放热反应,升高温度平衡向逆反应方向移动,故T(8)<T(15),
故答案为:<;
④8min时,平衡时c(Cl2)=0.3mol/L、c(CO)=0.1mol/L、c(COCl2)=0.9mol/L,则原平衡时n(Cl2):n(CO):n(COCl2)=3:1:9,现在第7 min 加入体系中的三种物质各2 mol,则反应物的浓度增大程度大些,平衡正向移动,
故答案为:向右;
(3)①HNO2是弱酸,次氯酸电离是吸热反应,酸碱中和反应是放热反应,当恰好完全中和时放出热量最多,c(NaOH)=$\frac{0.020L×0.01mol/L}{0.020L}$=0.01mol/L;
故①错误,②正确;
③电离吸热,温度越高电离平衡常数越大,所以HNO2的电离平衡常数:b点>a点,故③正确;
④从b点到c点,当C(NaOH)较大时,可能出现:c(Na+)>c(OH-)>c(NO2-)>c(H+),故④错误;
故答案为:②③;
点评 本题考查热反应方程式、化学平衡计算、化学平衡影响因素、化学平衡常数、反应速率计算等,侧重考查学生对图象与数据的分析及计算能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2,2,3,3-四甲基丁烷 | B. | 2,3,3,4-四甲基戊烷 | ||
| C. | 3,4-二甲基己烷 | D. | 2,5-二甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. 和XY2
和XY2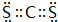 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氨水稀释后,溶液中 的值减小 的值减小 | |
| B. | 0.1mol•L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 | |
| C. | 电解精炼铜过程中,阳极质最的减少与阴极质量的增加一定相等 | |
| D. | 298K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
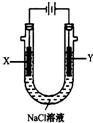
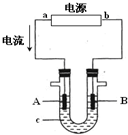 电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定终点读数时,仰视滴定管的刻度,其它操作均正确 | |
| B. | 盛装未知液的滴定管用蒸馏水洗过,未用待测液润洗 | |
| C. | 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 | |
| D. | 未用标准液润洗碱式滴定管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数 (25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 25℃时,若将pH=3的盐酸与pH=11的氨水混合后溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水) | |
| B. | 0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 结合H+的能力:CO32->HCO3->CN->HCOO- | |
| D. | 0.1mol/L的NaHCO3溶液中:c(H2CO3)+c(H+)=c(OH-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com