
����Ŀ��C��NaMO2����ǿ�ѧ�������з��������ӵ�أ���Ϥ�õ�ؿ��Խ���ͳ﮵�ص�������������7�����õ�صĵ�ط�ӦʽΪ��NaMO2+nCNa��1��x��MO2+NaxCn �� �����йظõ�ص�˵����ȷ���ǣ������� 
A.��طŵ�ʱ����Һ�����������ƶ�
B.��س��ʱ��������ӦʽΪ��nC+x Na+��xe���TNaxCn
C.������ͬ��������ʱ������������������ӵ����ʵ���������ʱ��
D.�õ�ظ����ĵ缫��ӦΪ��NaMO2��xe���TNa��1��x��MO2+xNa+
���𰸡�D
���������⣺A����طŵ�ʱ����ԭ��صĹ���ԭ����ԭ����У�������е����������������������������������ƶ�����A����
B����س��ʱ���ǵ���װ�õĹ���ԭ���������Ϸ���ʧ���ӵ�������Ӧ���缫��ӦʽΪNaxCn��xe���TnC+x Na+����B����
C����Na��Ħ������Ϊ23g/mol���� ![]() ��ʧȥ�ĵ�������֪��������ͬ��������ʱ�����������ʱ���������ӵ����ʵ������ƶ࣬��C����
��ʧȥ�ĵ�������֪��������ͬ��������ʱ�����������ʱ���������ӵ����ʵ������ƶ࣬��C����
D����طŵ�ʱ����������ʧ���ӵ�������Ӧ����NaMO2��xe���TNa��1��x��MO2+xNa+����D��ȷ��
��ѡ��D��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ʯ��Ӧ�Ʊ�������̼ʱ������ʹ��Ӧ�������Լӿ����
A.��״����ʯ����B.�����Ũ������һ��
C.�������������һ��D.�¶�����10��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ2A(s)+3B(g)![]() C(g)+2D(g) ��H��0����һ�������´ﵽƽ�⣬�����й�������ȷ����
C(g)+2D(g) ��H��0����һ�������´ﵽƽ�⣬�����й�������ȷ����
������A������ƽ��������Ӧ�����ƶ�
�������¶ȣ�ƽ�����淴Ӧ�����ƶ���v(��)��С
��ѹǿ����һ����ƽ�ⲻ�ƶ���v(��)��v(��)����
������B��Ũ�ȣ�ƽ��������Ӧ�����ƶ�
�ݼ��������B��ת�������
A. �٢� B. �� C. �� D. �ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����5mol��L-1 ����10mLϡ�͵�200mL����ȡ��5mL����5mL��Һ�����ʵ���Ũ���ǣ��� ��
A. 0.05mol/L B. 0.1mol/L C. 0.5mol/L D. 0.25mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ж���ȷ����( )
A. 1LH2O���ܽ���0.5molNaCl�������Һ�����ʵ���Ũ��Ϊ0.5molL��1
B. ��1L1molL��1���ǣ�C12H22O11����Һ��ȡ��100mL��Һ�������ʵ�����Ũ����Ϊ1molL��1
C. 0.5molL��1��NaOH��Һ�У�����0.5molNa+
D. 1L H2SO4��Һ�к���98g H2SO4�������Һ�����ʵ���Ũ��Ϊ98gL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�ܱ������м���0.3mol A��0.1mol C ��һ������ B �������壮һ�������·�����Ӧ��������Ũ����ʱ��仯���ͼ��ʾ[t0��t1�� c��B��δ����]����ͼ��Ϊ t2ʱ�̺�ı�����ƽ����ϵ�з�Ӧ������ʱ��仯����������ĸ��ζ����ı�һ�ֲ�ͬ����������������������ͬ����֪��t3��t4��Ϊʹ�ô���������˵����ȷ���ǣ� �� 
A.��t1=15s��������C��t0��t1ʱ��ε�ƽ����Ӧ����Ϊ0.004mol?L��1?min��1
B.t4��t5�θı������Ϊ���ͷ�Ӧ�¶�
C.B����ʼ���ʵ���Ϊ0.02mol
D.t5��t6��������A�����ʵ�������0.03mol�����˹����������������Ƚ�������ΪakJ���÷�Ӧ���Ȼ�ѧ����ʽΪ3A��g�� ![]() B��g��+2C��g������H=+100akJ?mol��1
B��g��+2C��g������H=+100akJ?mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ĸ�ͼ�� 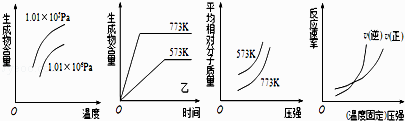
���з�Ӧ��ȫ����������ͼ��ķ�Ӧ�ǣ� ��
A.N2��g��+3H2��g��2NH3��g����H1��0
B.2SO3��g��2SO2��g��+O2��g����H2��0
C.4NH3��g��+5O2��g��4NO��g��+6H2O��g����H3��0
D.H2��g��+CO��g��C��s��+H2O��g����H4��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)һ���¶��£����ܱ������ڽ���ij��ѧ��Ӧ������X��Y�����ʵ����淴Ӧʱ��仯��������ͼ��ʾ��

��д���÷�Ӧ�Ļ�ѧ����ʽ_____________________��
����t1��t2ʱ����Ӧ���ʷֱ�Ϊv1��v2������ߴ�С��ϵΪv1________v2 (�>������ <����=��)��
����t1��t2��t3����ʱ���У���Ӧ��������________(�t1������ t2����t3��)��
(2)һ���¶��£���һ������N2��H2����̶�������ܱ������н��з�Ӧ��N2(g)+3H2(g) ![]() 2NH3(g)��
2NH3(g)��
������������˵���ÿ��淴Ӧ�ﵽ��ѧƽ��״̬����_______��
A.�����ڵ�ѹǿ����
B.������������ܶȲ���
C.��ͬʱ������3molH-H�����ѣ���6molN-H���γ�
D.c(N2)��c(H2)��c(NH3)=1��3��2
E.NH3�������������ٸı�
������ʼʱ�������г���10mol��L-1��N2��15mol��L-1��H2��10minʱ���������NH3��Ũ��Ϊ1.5mol��L-1��10min��N2��ʾ�ķ�Ӧ����Ϊ________����ʱH2��ת����Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ�آ١����ڱ��е�λ�ã��ش��������⣺

(1)�۵ļ��⻯��ĽṹʽΪ__________��
(2)�١��ܡ�������Ԫ����ɻ�����ĵ���ʽΪ__________��
(3)�ڡ��ۡ��ߵ�����������Ӧ��ˮ����������ǿ������˳����__________���û�ѧʽ��ʾ����
(4)�ĵ�����NaOH��Һ��Ӧ�����ӷ���ʽΪ__________��
(5)�ߵ�����⻯����һ����ɫ���壬���������ܷ�����ը��ȼ����Ӧ�Ļ�ѧ����ʽΪ__________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com