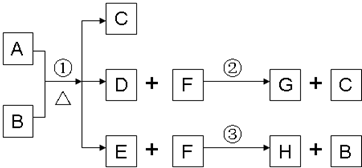
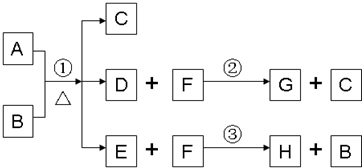
解:(1)根据题意,A是一种常见金属,H为黑色沉淀,中学阶段接触的黑色沉淀为硫化铜,故A为金属铜,H为硫化铜,所以除A、C外其余各物质均含同一种元素即硫元素,B则为硫酸,F为硫化氢,D为硫酸铜,G为硫,硫酸是共价化合物,属于分子晶体,相互作用力为分子间作用力,铜和浓硫酸反应的方程式为:Cu+2H
2SO
4
CuSO
4+SO
2↑+H
2O,故填:分子晶体、分子间作用力、Cu+2H
2SO
4
CuSO
4+SO
2↑+H
2O;
(2)硫和热的氢氧化钠溶液反应的方程式为:3S+6NaOH

2Na
2S+Na
2SO
3+3H
2O,故填:3S+6NaOH

2Na
2S+Na
2SO
3+3H
2O;
(3)硫酸根的检验方法为:向待测液中加入硝酸酸化的氯化钡看是否有白色沉淀,故填:向硫酸铜溶液中加入硝酸酸化的氯化钡,如果出现白色沉淀,证明有硫酸根,反之,则没有;
(4)用二硫化亚铁生产硫酸是在沸腾炉中进行的,二硫化亚铁燃烧的方程式为:4FeS
2+11O
2
2Fe
2O
3+8SO
2,转移电子数目为44mol,故填:
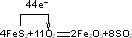
.
分析:(1)根据硫酸所属的化合物类型来判断其晶体类型,根据晶体类型来确定分子中的作用力,根据物质的性质来书写化学方程式;
(2)根据硫能溶于热的强碱溶液的化学性质来回答;
(3)根据硫酸根的特征离子反应:遇钡离子产生不溶于硝酸的白色沉淀来回答;
(4)根据工业上利用二硫化亚铁来制备硫酸的原理进行回答,根据氧化还原反应中的电子转移情况来分析;
点评:本题是一道框图推断题,考查了元素及化合物的知识,要求学生具有分析和解决问题的能力.

 CuSO4+SO2↑+H2O,故填:分子晶体、分子间作用力、Cu+2H2SO4
CuSO4+SO2↑+H2O,故填:分子晶体、分子间作用力、Cu+2H2SO4 CuSO4+SO2↑+H2O;
CuSO4+SO2↑+H2O; 2Na2S+Na2SO3+3H2O,故填:3S+6NaOH
2Na2S+Na2SO3+3H2O,故填:3S+6NaOH 2Na2S+Na2SO3+3H2O;
2Na2S+Na2SO3+3H2O; 2Fe2O3+8SO2,转移电子数目为44mol,故填:
2Fe2O3+8SO2,转移电子数目为44mol,故填: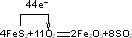 .
.