
| A. | 0.4mol/L | B. | 0.3mol/L | C. | 0.2mol/L | D. | 0.5mol/L |
分析 将碳酸钠溶液逐滴滴入盐酸中,盐酸过量,发生反应是Na2CO3+2HCl=2NaCl+CO2↑+H2O,将盐酸逐滴滴入碳酸钠溶液中,碳酸钠过量,首先发生的反应是Na2CO3+HCl=NaHCO3+NaCl,碳酸钠反应完后,再发生反应是NaHCO3+HCl=NaCl+CO2+H2O,如果对两个过程,盐酸都过量,则两次产生CO2应该一样多,但两者不同,说明在第一个过程中盐酸完全反应,碳酸钠有剩余,第二过程中盐酸也完全反应,但有碳酸氢钠剩余.
根据HCl的物质的量计算第一个过程的二氧化碳的物质的量,进而计算第二个过程生成二氧化碳的物质的量,根据方程式:NaHCO3+HCl=NaCl+CO2+H2O计算参加该反应的HCl的物质的量,进而计算反应:Na2CO3+HCl=NaHCO3+NaCl中消耗的HCl的物质的量,据此计算Na2CO3的物质的量,再根据c=$\frac{n}{V}$计算.
解答 解:将盐酸滴入碳酸钠溶液中,发生反应:Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl═NaCl+CO2↑+H2O,将碳酸钠溶液滴入盐酸中,发生反应:Na2CO3+2HCl═2NaCl+CO2↑+H2O,若盐酸均足量,生成二氧化碳体积相等,而实际生成二氧化碳的体积之比为3:2,故盐酸不足,HCl物质的量为0.3L×1mol/L=0.3mol,故碳酸钠溶液滴入盐酸中生成二氧化碳的物质的量为0.3mol×$\frac{1}{2}$=0.15mol,则盐酸滴入碳酸钠溶液中生成二氧化碳的物质的量为0.15mol×$\frac{2}{3}$=0.1mol,故反应NaHCO3+HCl=NaCl+CO2+H2O中消耗的HCl为0.1mol,反应Na2CO3+HCl=NaHCO3+NaCl中消耗的HCl为0.3mol-0.1mol=0.2mol,故碳酸钠的物质的量为0.2mol,物质的量浓度为$\frac{0.2mol}{0.5L}$=0.4mol/L,
故选A.
点评 本题考查化学方程式有关计算,明确盐酸与碳酸钠反应,滴加顺序不同发生反应不同是解题关键,侧重考查学生分析计算能力,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

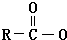 Na+NaOH$→_{△}^{CaO}$R-H+Na2CO3
Na+NaOH$→_{△}^{CaO}$R-H+Na2CO3 ,K的结构简式为
,K的结构简式为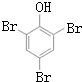 .
.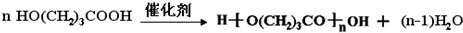 ;
;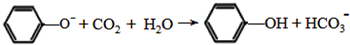 .
. (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上电解饱和食盐水的阳极反应为:2Cl--2e-═Cl2↑ | |
| B. | 船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁吸氧腐蚀的正极反应为:O2+2H2O+4e-═4OH- | |
| D. | 铁表面镀锌,铁作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶剂的质量 | B. | 溶质的质量分数 | ||
| C. | NH4Cl的溶解度 | D. | 溶液中NH4+的数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极为Fe、负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为Ag、负极为Fe,电解质溶液为CuSO4溶液 | |
| C. | 正极为Fe、负极为Zn,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为C、负极为Fe,电解质溶液为Fe(NO3)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应一定是非自发的化学反应,放热反应不需要加热就能发生反应 | |
| B. | 其它条件不变时,增大压强可以增大活化分子百分数,使化学反应速率加快 | |
| C. | 温度、压强一定时,熵增加的反应都能自发进行 | |
| D. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{2}$H、${\;}_{1}^{1}$H | B. | 红磷、白磷 | ||
| C. | Na2O、Na2O2 | D. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com