
 +CH2OH5$\stackrel{催化剂}{→}$
+CH2OH5$\stackrel{催化剂}{→}$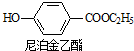 +H2O
+H2O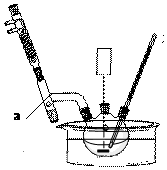
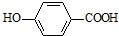
分析 ①在三口烧瓶中加入6.9g对羟基苯甲酸和9.2g无水乙醇,加入适量氨基磺酸(固体催化剂),接通冷凝水,然后加热、搅拌并回流,至充分反应,
②趁热过滤出催化剂,将残液迅速倾入冷水,固体粗酯从水中析出,再过滤,
③滤饼用5%Na2CO3和水洗涤,得粗酯,
④粗酯、乙醇、水和活性炭加入圆底烧瓶中,加热回流30min,趁热抽滤,滤液冷却结晶、60℃烘干,得产品7.5g,
(1)仪器A为分水器,尼泊金乙酯易溶于乙醇,水分离器中液体不再变化说明反应结束;
(2)碳酸钠溶液中碳酸根离子水解溶液显碱性,溶解乙醇,和对羟基苯甲酸反应,降低酯的溶解度;
(3)活性炭具有吸附作用;
(4)在三口烧瓶中加入6.9g对羟基苯甲酸和9.2g无水乙醇,结合化学方程式定量关系计算分析完全反应的物质,通过化学方程式计算理论量,产率=$\frac{实际量}{理论量}$×100%.
解答 解:(1)图中仪器a的名称是分水器,步尼泊金乙酯易溶于乙醇,骤①中乙醇过量,其目的是高对羟基苯甲酸的转化率同时作溶剂,分水器中水的量不再增加说明反应已完成,
故答案为:分水器;提高对羟基苯甲酸的转化率同时作溶剂;分水器中水的量不再增加;
(2)步骤③滤饼用5%Na2CO3和水洗涤的目的是除去未反应的对羟基苯甲酸及乙醇,
故答案为:除去未反应的对羟基苯甲酸及乙醇;
(3)活性炭具有吸附作用,步骤④精制时加入活性炭的目的是吸附产品中有色杂质,
故答案为:吸附产品中有色杂质;
(4)在三口烧瓶中加入6.9g对羟基苯甲酸和9.2g无水乙醇, +C2H5OH$\stackrel{催化剂}{→}$
+C2H5OH$\stackrel{催化剂}{→}$ +H2O
+H2O
138 46 166
6.9g 2.3g 8.3g
乙醇过量,依据对羟基苯甲酸计算尼泊金乙酯质量8.3g
通过化学方程式计算理论量8.3g,产率=$\frac{实际量}{理论量}$×100%=$\frac{7.5g}{8.3g}$×100%=90.4%
故答案为:0.904;
点评 本题考查有机物制备实验,涉及酯化反应、物质的分离提纯、平衡移动原理应用、对信息的获取与运用、实验基本操作等,题目难度中等.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
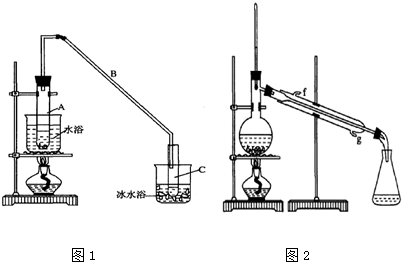
 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O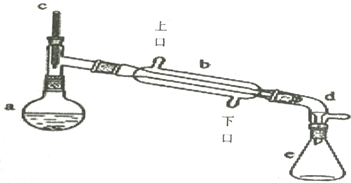
| 相对分子质量 | 密度/(g.cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 甲苯(
甲苯(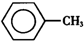 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(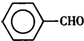 )、苯甲酸(
)、苯甲酸(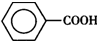 )等产品.下表列出了有关物质的部分物理性质,请回答:
)等产品.下表列出了有关物质的部分物理性质,请回答:| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度 (ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
 ,此反应的原子利用率理论上可达66.25%.【原子利用率=$\frac{期望产物的总质量}{全部反应物的总质量}$×100%】
,此反应的原子利用率理论上可达66.25%.【原子利用率=$\frac{期望产物的总质量}{全部反应物的总质量}$×100%】查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同的条件下,2mol 氢气与 1 mol 氧气的总能量小于2mol 水蒸气的总能量 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)→H2O(1)+Q1;Q1>241.8kJ | |
| C. | H2(g)+$\frac{1}{2}$O2(g)→H2O(1)+Q2;Q2<241.8kJ | |
| D. | 任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水溶解氯化银沉淀:AgCl+2NH3•H2O=[Ag(NH3)2]+Cl-+2H2O | |
| B. | 向Na2S2O3溶液中通入足量氯水:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ | |
| C. | 酸性K2Cr2O7溶液氧化双氧水:Cr2O72-+8H++5H2O2=2Cr3++4O2↑+9H2O | |
| D. | 1.0mol/L的NaAlO2溶液和2.5mol/L盐酸等体积混合:AlO2-+4H+=5Al3++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com