

| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1mol/L硫酸溶液 | 10mL | t1 | v1 |
| 4mol/L硫酸溶液 | 10mL | t2 | v2 |
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 硫酸浓度(mol/L) | 4.0 | 3.8 | 3.5 | 3.1 | 2.6 | 2.2 | 1.9 | 1.8 | … |
分析 (1)图示装置按照发生装置、排水法测量气体体积的顺序进行连接;
(2)锥形瓶中锌与稀硫酸反应生成硫酸锌和氢气,据此写出反应的离子方程式;
(3)根据浓度对反应速率的影响进行判断t1、t2的大小关系;
(4)根据表中不同时间段稀硫酸的浓度可以画出v(H2)-t的图象;根据该反应为放热反应及温度对反应速率的影响进行判断;
(5)还可以通过测定相同时间内生成氢气的体积来判断浓度对反应速率的影响.
解答 解:(1)根据图示装置可知,实验目的是通过排水法测定生成氢气体积,其中集气瓶中的导管应该为短进长出法,所以导管连接顺序为:a→c→b→d,
故答案为:c;b;d;
(2)锥形瓶中稀硫酸与金属锌发生反应生成氢气,反应的离子方程式为:Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑;
(3)其它条件相同时,稀硫酸的浓度越大,反应速率越快,收集相同体积的氢气需要的时间越短,所以t1>t2,故答案为:t1>t2;
(4)由表中时间与稀硫酸的浓度关系可以画出v(H2)-t的图象为: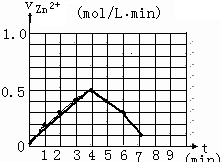 ;由于该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快,
;由于该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快,
故答案为: ;该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快;
;该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快;
(5)除上述实验方案可定量测定该反应的化学反应速率外,还可以通过测定相同时间内测定生成H2的体积进行判断浓度对反应速率的影响,
故答案为:相同时间内测定生成H2的体积(或相同时间内测定Zn的质量)(其他合理答案均可).
点评 本题考查了探究浓度对反应速率的影响的方法,题目难度中等,注意明确难度对化学反应速率的影响,要求学生能够合理设计出探究浓度对反应速率影响的实验方案,并能够对实验方案的合理性进行正确评价.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液加水稀释后,恢复至原温度,所有离子浓度均减小 | |
| B. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 | |
| C. | pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)前者大 | |
| D. | 0.1mol•L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都可以使溴水反应褪色 | |
| B. | 甲烷和乙烯都可以与氯气反应 | |
| C. | 乙烯可以与氢气发生加成反应,苯不能与氢气加成 | |
| D. | 液化石油气和天然气的主要成分都是甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
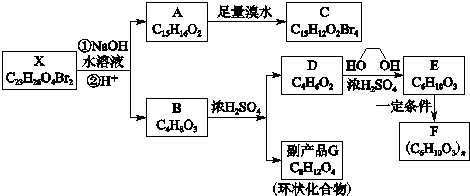
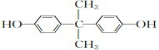
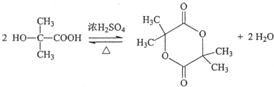 .写出E→F反应的化学方程式
.写出E→F反应的化学方程式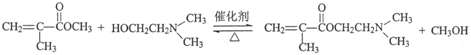 .
.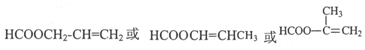 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示 (已知硝酸只被还原为NO气体).
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示 (已知硝酸只被还原为NO气体).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
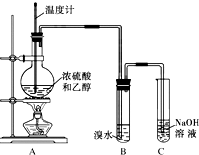 为探究乙烯的制取及乙烯和溴水反应的有关问题,甲、乙、丙三同学进行了如下实验活动,请你参与他们的活动并回答相关问题.
为探究乙烯的制取及乙烯和溴水反应的有关问题,甲、乙、丙三同学进行了如下实验活动,请你参与他们的活动并回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-,Cl-,Na+,Ba2+ | B. | AlO2-,S2-,Na+,K+ | ||
| C. | SiO32-,Cl-,K+,Na+ | D. | Ba2+,Al3+,NO3-,Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 实验序号 | 试管中的药品 | 现象 |
 | 实验Ⅰ | 2mL银氨溶液和数滴较浓NaOH溶液 | 有气泡产生,一段时间后,溶液逐渐变黑,试管壁附着银镜 |
| 实验Ⅱ | 2mL银氨溶液和数滴较浓氨水 | 有气泡产生,一段时间后,溶液无明显变化 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com